- QFB Nadia Martínez
En los últimos años, ha habido un cambio en el panorama de la salud que va desde los medicamentos exitosos a partir de fármacos de moléculas pequeñas, hasta los productos biológicos. Mientras los medicamentos de moléculas pequeñas dominan el mercado farmacéutico global en términos de números, siete de los 10 medicamentos más vendidos en 2018 fueron productos biológicos.
Los productos biológicos están regulados por la FDA y se emplean para diagnosticar, prevenir, tratar y curar enfermedades. Los productos biológicos son una categoría amplia de productos y generalmente son moléculas grandes y complejas. Existen diversos tipos de productos biológicos aprobados para su uso en Estados Unidos, incluidas las proteínas (como filgrastim), anticuerpos monoclonales (como adalimumab) y vacunas (como las de la influenza y tetanos).
La naturaleza de estos productos, incluyendo las variaciones inherentes que resultan de su proceso de manufactura, puede representar mayores retos en su caracterización y fabricación. Las diferencias ligeras entre distintos lotes de un mismo producto biológico son normales y aceptables. La FDA evalúa el proceso y la estrategia de manufactura para controlar las variaciones dentro de un mismo producto. Estas estrategias se llevan a cabo para asegurar que los fabricantes obtienen productos biológicos con un desempeño clínico consistente.
El Congreso, a través de la Ley de Innovación y Competencia de Precios de los productos Biológicos (BPCI, por sus siglas en inglés), creo una vía más rápida para la obtención de licencias, con el fin de brindar más opciones de tratamientos, aumentar el acceso a medicamentos y potencialmente reducir los costos de atención médica a través de la competencia.
El incremento en el alto precio de los productos biológicos está ejerciendo una presión sobre los presupuestos sanitarios, por lo que los productos biosimilares se vuelven cada vez más importantes a medida que vencen las patentes de los productos biológicos originales. En el documento publicado en el volumen 8 del año 2019 de la GaBi (Revista de las Iniciativas de Genéricos y Biosimilares, por sus siglas en inglés) se presenta una actualización de las fechas de vencimiento de patentes de algunos de los productos biológicos más vendidos. (Ver tabla)
Los productos biológicos representan muchas de las nuevas alternativas terapéuticas más prometedoras para las enfermedades previamente intratables y se vuelven cada vez más importantes en el mercado farmacéutico. El mercado biológico global tiene un valor estimado de aproximadamente 276 mil millones de dólares (mdd) y durante 2018, siete de los 10 medicamentos más vendidos fueron productos biológicos comparados con sólo tres en 2008. El mercado de los biosimilares está creciendo rápidamente; sin embargo, sólo representa menos del 2% de las ventas globales de los productos biológicos (4.6% de las ventas en Europa).
Se espera que el mercado global de los biosimilares incremente de los 5.95 mil mdd en 2018 hasta 23.63 mil mdd para el 2023, de acuerdo a un reporte del Markets and Markets. Geográficamente, el mercado de los biosimilares está dominado por Europa, seguido de Asia, Norteamérica y el resto del mundo; se espera que Europa mantenga ese lugar al menos hasta el 2023. El crecimiento del mercado de los biosimilares en Europa está dado principalmente por la necesidad de reducir los costos del cuidado de la salud, la caducidad de las patentes de los biológicos y la llegada de los nuevos biosimilares, así como el aumento en la incidencia de enfermedades crónicas.
El tratamiento de las enfermedades autoinmunes, el cáncer y la diabetes representan arriba del 60% del mercado de los productos biológicos. Con el incremento de la prevalencia de las enfermedades crónicas, el catálogo se expande rápidamente, con un aproximado de 800 productos actualmente. En 2016, aproximadamente 50% de las nuevas moléculas aprobadas por la FDA fueron productos biológicos.
El producto con mayores ventas en el mundo, Humira, de AbbVie (15000 millones de euros en 2017), perdió su patente en el último trimestre del 2018 en Europa. Se trata de un anticuerpo monoclonal humano cuya sustancia activa es el adalimumab que actúa sobre el factor de necrosis tumoral (TNFα), disminuyendo el proceso inflamatorio en ciertas enfermedades como la artritis.
El vencimiento de dicha patente dio pie a la entrada del producto biosimilar y a disputarse un negocio superior a los 50000 millones. Otras compañías en riesgo por el próximo vencimiento de patentes en este negocio son Roche, Amgen y Johnson & Johnson.
Se espera que los precios al por mayor de los biológicos para el 2022 habrán incrementado un 8 a 11% y los precios netos aproximadamente un 2 al 5%. El incremento del precio de los medicamentos para el cáncer, de acuerdo con la OMS, está afectando la capacidad de los sistemas de salud para proporcionar un acceso asequible a la población de los medicamentos para el cáncer. El modo que existe para combatir esto es precisamente introducir los productos biosimilares en los que la patente venció o está por vencer.
Con respecto a las patentes ha habido una armonización global importante.
Historia de los biosimilares aprobados por la FDA hasta el momento
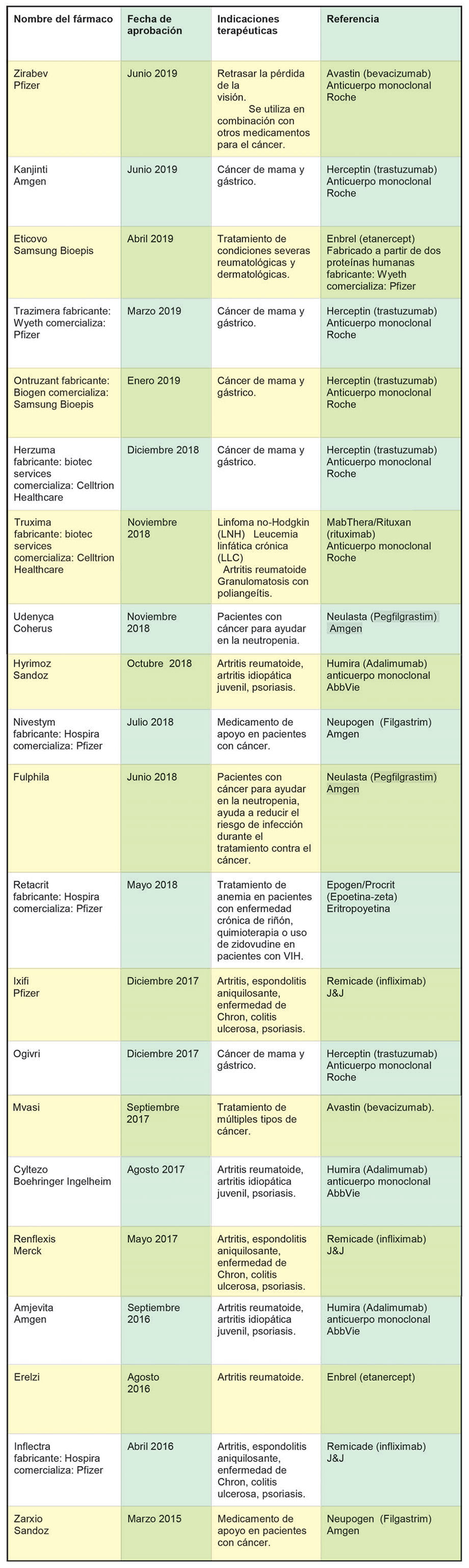
El primer producto biosimilar fue aprobado por la FDA en el primer trimestre del 2015. Se trató de Zarxio, de Sandoz. Este producto estaba basado en el biológico Neupogen (filgrastim), de Amgen. El producto original fue aprobado en 1991. Es un medicamento de apoyo para los pacientes con cáncer que estén recibiendo quimioterapia o pacientes con cáncer a los que se somete a un trasplante de médula ósea y pacientes con neutropenia crónica grave.
Para abril de 2016, la FDA ya estaba aprobando Inflectra (infliximab-dyyb) para varias indicaciones. Este fue el segundo producto biosimilar aprobado por la agencia. El Inflectra es biosimilar al Remicade (infliximab) de Janssen Biotech, Inc., que originalmente fue autorizado en 1998.
En agosto de 2016, la FDA aprobó el Erelzi, (etanercept-szzs) empleado para el tratamiento de diversas enfermedades inflamatorias. Erelzi es el biosimilar de Enbrel (etanercept), que obtuvo la licencia sanitaria en 1998.
En septiembre de 2017, la FDA aprobó el primer producto biosimilar para el tratamiento de cáncer de mama y cáncer gástrico. Este producto fue Mvasi (bevacizumab-awwb) como biosimilar de Avastin (bevacizumab). Mvasi es el primer biosimilar aprobado por la FDA para el tratamiento de cáncer. Se utiliza en tratamiento de pacientes adultos con cáncer colorectal, de pulmón, cerebro, riñón y cérvico-uterino.
Para finales de noviembre del año pasado, la FDA había aprobado 15 productos biosimilares y continúa trabajando en nuevas políticas para mejorar la eficiencia del desarrollo y revisión de estos productos. En ese periodo aprobó al primer producto biosimilar para el tratamiento a los pacientes adultos con linfoma no Hodgkin´s.
La FDA aprueba los productos biosimilares y proporciona la asesoría científica y regulatoria necesaria para llevar al mercado productos biosimilares efectivos. La aprobación de los productos biosimilares conduce a un mayor número de opciones de medicamentos para el cuidado de la salud de los pacientes y a un costo potencialmente más bajo. En la siguiente tabla se encuentran los distintos productos biosimilares aprobados hasta el momento por la FDA.
Los productos biosimilares en México
En 2017, la COFEPRIS incluyó por primera vez en su paquete de medicamentos, los primeros fármacos biocomparables. Este tipo de medicamentos representa una gran oportunidad para el sistema nacional de salud debido a que puede generar grandes ahorros por su precio y por la reducción de costos de hospitalización de pacientes con enfermedades como la diabetes mellitus, obesidad y padecimientos cardiovasculares que han crecido en las últimas décadas.
De acuerdo con la COFEPRIS, 35% de las solicitudes de nuevos registros de sustancias innovadoras están relacionadas con moléculas derivadas de procesos biotecnológicos, especialmente las dedicadas a la atención del cáncer y enfermedades reumatológicas y neurológicas.
Con base en la NOM257, los medicamentos biotecnológicos se clasifican en tres:
Medicamento biotecnológico innovador: medicamento biotecnológico que sea el primero en obtener el registro sanitario en México, así reconocido por la Secretaría de Salud (SSA).
Medicamento biotecnológico de referencia: medicamento biotecnológico innovador que se utilice de referencia para el registro de medicamentos biotecnológicos biocomparables y que sea reconocido como tal por la SSA.
Medicamento biotecnológico biocomparable: medicamento biotecnológico no innovador que demuestre ser biocomparable en términos de seguridad, calidad y eficacia al medicamento biotecnológico de referencia a través de las pruebas que establezca la Ley, el Reglamento de Insumos para la Salud y demás disposiciones aplicables.
Se han reconocido oficialmente algunos medicamentos biocomparables de empresas como Sandoz, Eli Lilly, Celltrion y fabricantes nacionales. Se habilitaron algunos centros como Terceros Autorizados para realizar estudios de biocomparabilidad: en la UNAM, IPN, CIATEJ, IBT. Además se han autorizado Unidades Clínicas para realizar estudios de biocomparabilidad.
A finales del año pasado, se celebró en nuestro país el Foro Biosimilars LATAM 2018. En dicho foro se reunieron directivos de las principales empresas biofarmacéuticas y se discutieron diversos temas como la posición actual de las agencias regulatorias tras el nuevo gobierno. Se mostró preocupación porque con los cambios puedan ponerse en riesgo los estándares internacionales que se han logrado hasta ahora. Otro tema que se discutió fue la necesidad de los estudios clínicos para el registro de los biosimilares llegando a la conclusión del requerimiento de una fase IV robusta.
En el mundo
Dentro del IPRP (Programa Internacional de Reguladores Farmacéuticos, por sus siglas en inglés) se encuentra el grupo de trabajo enfocado en los biosimilares integrado por expertos de distintos países:
- ANVISA, Brasil.
- COFEPRIS, México.
- EAC.
- EC/EMA, Europa.
- FDA, Estados Unidos.
- Health Canada, Canadá.
- HSA, Singapur.
- MFDS, República de Corea.
- MHLW/PMDA, Japón.
- PAHO/PANDRH.
- GHC.
- Swissmedic, Suiza.
- TFDA, China Taipéi.
- TGA, Australia.
- OMS
El trabajo colaborativo de este comité ha contribuido en un incremento en las aprobaciones y una disminución en el tiempo de respuesta:
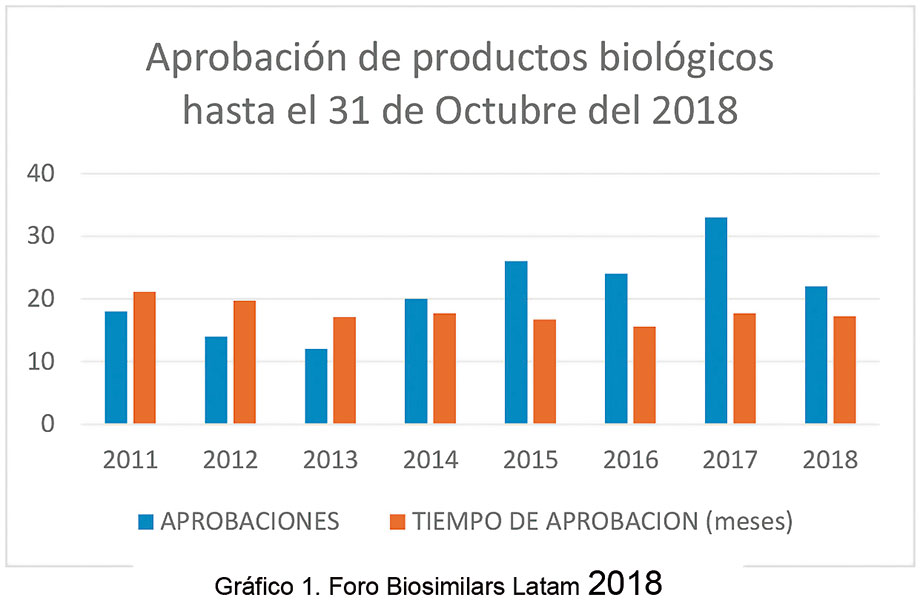
Han surgido alianzas estratégicas y acuerdos de licencia en los distintos mercados. Ha habido una mejora continua en la estructura regulatoria y una mejora en la transparencia.

Los productos biológicos intercambiables
La FDA anunció el 10 de Mayo del 2019 que había emitido una guía final de la vía para los productos biológicos intercambiables.
La guía final, de acuerdo con Norman Sharpless, comisionado de la FDA proporciona una visión general de las consideraciones importantes para demostrar la intercambiabilidad con un producto de referencia y explica las recomendaciones científicas para una aplicación o un suplemento para un producto intercambiable propuesto.
La guía se publica dos años después de haberse propuesto el borrador. La guía final proporciona una visión general de las consideraciones científicas importantes al demostrar la intercambiabilidad con el producto de referencia y explica las recomendaciones científicas para una aplicación o un suplemento para un producto intercambiable propuesto.
Hasta la fecha no se ha aprobado ningún biosimilar intercambiable en los Estados Unidos. Únicamente se sabe de una compañía, Boehringer Ingelheim, que se encuentra actualmente buscando la intercambiabilidad, e incluso ha revelado públicamente que ha iniciado un estudio de intercambiabilidad para su adalimumab biosimilar.
El Dr. Sharpless, comisionado interino de la FDA, mencionó que la agencia consideró los comentarios del borrador de guía e hizo cambios para mejorar la claridad para las partes interesadas.
Esta guía proporciona una visión general de consideraciones importantes científicas para demostrar la intercambiabilidad con un producto de referencia incluyendo las siguientes:
- Datos e información necesaria que apoye en la demostración de la intercambiabilidad
- Consideraciones para el diseño y análisis del estudio o estudios que apoyen la demostración de la intercambiabilidad.
- Consideraciones sobre el producto con el que se compara en los estudios de intercambiabilidad.
- Consideraciones abreviadas para desarrollar presentaciones, sistemas
A pesar de que Europa encabeza el mercado de los productos biosimilares, ha enfrentado retos relacionados al consumo. El consumo varía notablemente entre los distintos países de Europa; siendo Italia y España de los países en el que estos productos se consumen poco en comparación con países como Austria, Alemania, Irlanda y Suecia en los que los biosimilares son muy bien aceptados. Esto se debe principalmente a las distintas políticas que hay en el continente.
Se ha logrado avanzar en el proceso de desarrollo de productos biosimilares para hacerlo más eficiente y de este modo los fabricantes tengan más oportunidades y así los productos puedan ser competitivos comercialmente. El portafolio de los productos biosimilares sigue creciendo. La FDA continuará asegurándose de que los medicamentos sean evaluados eficientemente a través de un proceso que asegure que estos medicamentos cumplan los estándares rigurosos de la FDA para su aprobación.











