En esta primera edición del año, de nueva cuenta me enfocaré en los medicamentos cuya patente está por vencer ya sea durante 2023 o en los años subsecuentes, además de los registros que se tuvieron de nuevos medicamentos durante 2022.
En los próximos 10 años, casi la mitad de los medicamentos de mayor venta en el mundo perderán su exclusividad en el mercado de acuerdo a un análisis publicado en los reportes de Fierce Pharma, haciendo las gigantes farmacéuticas todo lo posible para prepararse para la competencia. Tratan de proteger su producto con un portafolio sólido de patentes que le dificulte a la competencia hacer copias de su producto.
En los próximos años se perderá la patente de algunos anticoagulantes, oncológicos, medicamentos para artritis reumatoide y degeneración macular. De esta manera, las otras compañías pueden crear su versión genérica para ofrecer al público una opción más accesible. El número de competidores depende de la rentabilidad del medicamento.
Se espera un impacto importante en el mercado farmacéutico debido a la expiración de la patente de Humira (para la psoriasis), de AbbVie, que durante 2021 fue el medicamento más vendido junto con las vacunas para el Covid-19 y en 2022 fue el segundo más vendido después de la vacuna de Pfizer con ventas de 20,350 millones de dólares. La patente principal de éste expiró en 2016, sin embargo, la farmacéutica aseguró más de 200 patentes relacionadas que protegen al producto. Esta protección fue impugnada por Amgen y en 2017 las dos compañías llegaron a un acuerdo en el que Amgen recibió una licencia de patente y así luz verde para lanzar su biosimilar Amgevita en Estados Unidos este año que comienza. Abbvie ha llegado a varios acuerdos respecto a Humira en Estados Unidos con empresas como Boehringer Ingelheim, Pfizer, Samsung Bioepis, Mylan y Sandoz.
Otro medicamento de los más vendidos y cuya patente está por expirar es el Inhibidor GLP-1 Victoza de Novo Nordisk. En 2019, la compañía llegó a un acuerdo con la farmacéutica Teva para mantener las copias de Victoza fuera del mercado hasta finales de 2023. Desde entonces, Novo Nordisk recibió la aprobación de la extensión de la FDA para el uso de Victoza incluso en pacientes con diabetes tipo 2 más jóvenes, de 10 a 17 años, lo que podría posponer el lanzamiento del genérico.
Ibrance (palbociclib), de Pfizer, utilizado en el tratamiento de la postmenopausia con diferentes tipos de cáncer de mama y que había sido clave para los ingresos de la compañía antes de la pandemia. El vencimiento de su patente se espera para 2027.
Januvia (sitagliptina), de Merck, es un medicamento utilizado para el tratamiento de la diabetes tipo 2 cuyas patentes están por vencer este año. De su portafolio tuvo la tercera posición en ventas durante 2022.
Eliquis, de BMS y Pfizer, es un anticoagulante empleado para prevenir accidentes cerebrovasculares cuya patente vencerá para 2026. Las ventas de este producto durante 2021 fueron de 10,500 dólares y durante 2022 de 11,850 dólares, y se espera siga ocupando los primeros lugares de ventas por unos años más.
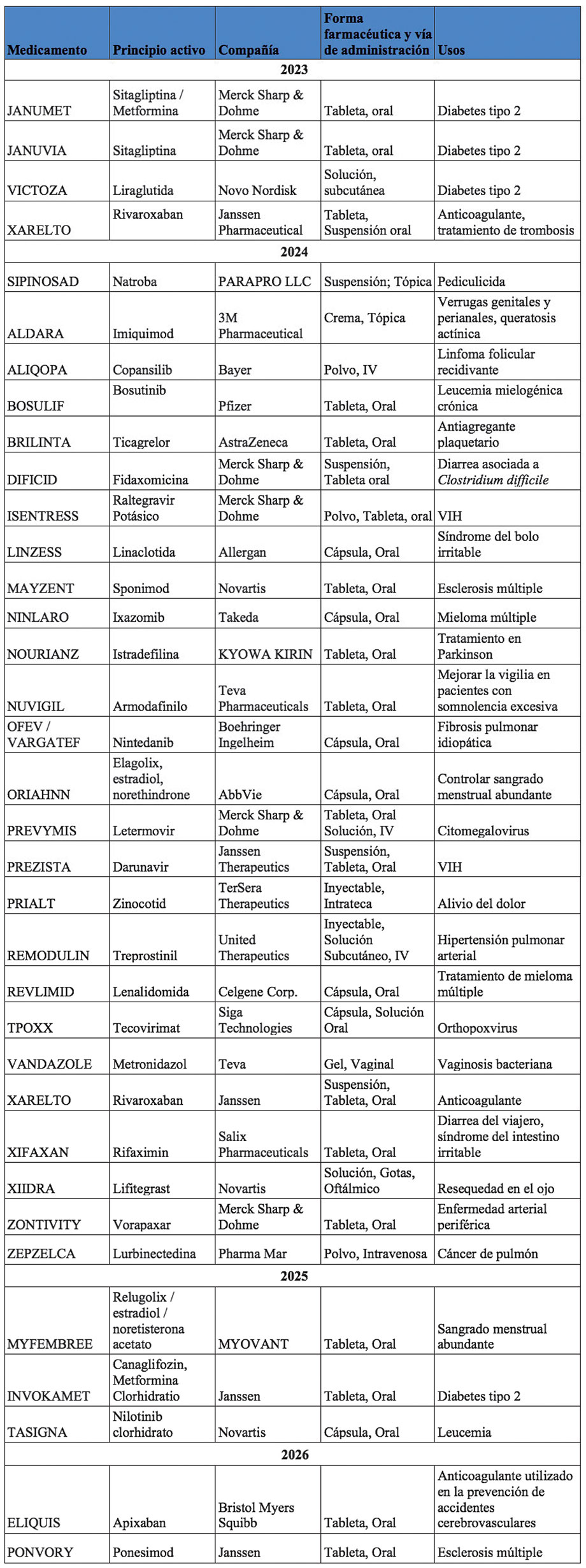
Dentro de los medicamentos que se encuentran en el “Libro Naranja” (Orange Book) de la FDA cuya patente está próxima a vencer tenemos los enlistados a continuación.
Dentro de las prioridades de la FDA para este año en relación a los productos genéricos se encuentran:
- Desarrollo de métodos para genéricos que permitan detectar impurezas como las nitrosaminas.
- Mejorar la eficiencia del alcance de bioequivalencia para ingredientes activos complejos.
- Mejorar la eficiencia del estudio de bioequivalencia para formas farmacéuticas y formulaciones complejas y el alcance de bioequivalencia para vías de administración complejas.
- Facilitar la utilidad de la evidencia integrada para respaldar la demostración de la Bioequivalencia.
- Expandir el Uso de Inteligencia Artificial y herramientas de aprendizaje automático (ML).
En cuanto a los productos innovadores, durante 2022, la FDA aprobó 37 productos, menos de los que habían sido en los últimos tres años (50 en promedio), además de algunas nuevas aplicaciones para otros productos que ya contaban con registro.
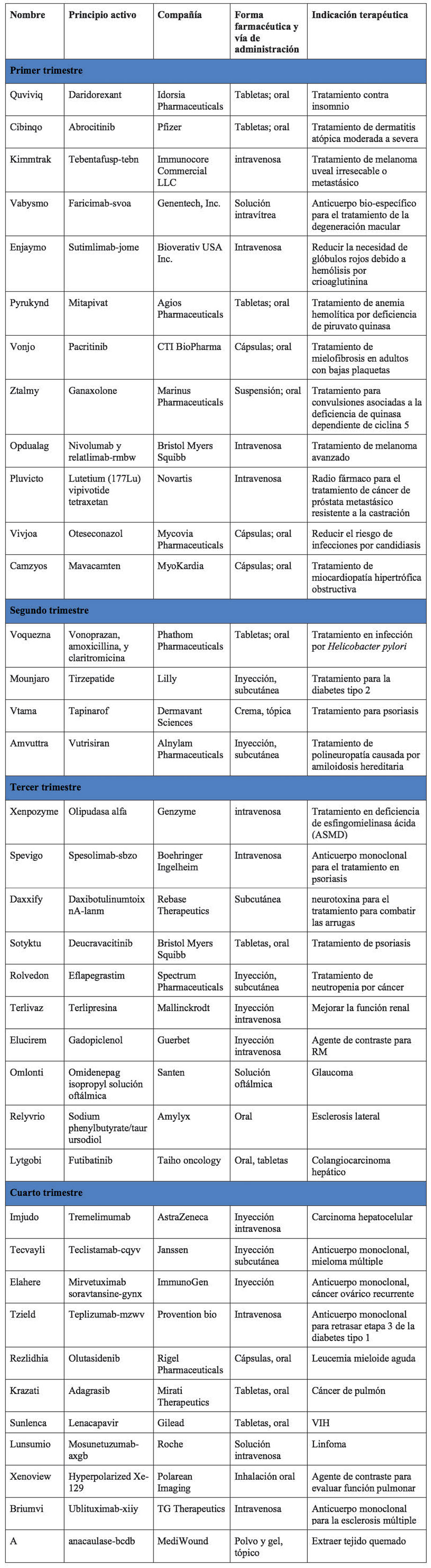
Trece de estos medicamentos fueron diseñados como terapia innovadora, entre ellos: Camzyos, Cibinqo, Enjaymo, Kimmtrak, Krazati, Lunsumio, Lytgobi, Pluvicto, Spevigo, Sunlenca, Tecvayli, Tzield y Xenpozyme.
Seis de los medicamentos innovadores tuvieron una aprobación acelerada durante 2022. Esto con el objetivo de tener en el mercado medicamentos que podrían lograr avances importantes en los tratamientos en un tiempo más corto del habitual y ofrecer una alternativa para tratar un padecimiento grave con una ventaja importante sobre los tratamientos disponibles. Para su aprobación se establecieron ciertos criterios que permitían estudiar el fármaco por un periodo más corto y predecir el beneficio del producto. La FDA solicita estudios post-aprobatorios que confirmen el beneficio clínico, entre otras cosas, pudiendo retirarlo del mercado en caso de que no se confirme dicho beneficio. Los productos que fueron aprobados de manera acelerada fueron: Elahere, Krazati, Lunsumio, Lytgobi, Tecvayli y Vonjo.
Con la aprobación de tantas nuevas moléculas, ha crecido el número de compañías farmacéuticas dedicadas al desarrollo y fabricación de medicamentos para terceros (CDMO). La innovación es de vital importancia y las herramientas digitales que apoyen el desarrollo de procesos robustos también seguirán en aumento, además del interés por la eliminación de materiales tóxicos y el impacto ambiental.
La importancia de la correcta selección y aprobación de proveedores de acuerdo con los requerimientos contribuye en el cumplimento de los objetivos por lo que se debe tener conocimiento de todas las opciones disponibles en el mercado y, así, poder elegir adecuadamente la mejor opción. Una vez seleccionados los proveedores, cuidar la relación con ellos de manera que se trabaje en conjunto para lograr el cumplimiento de los objetivos planteados para ambas partes.
Se espera que por los próximos años las vacunas contra Covid-19 sigan siendo en lo que se utilice la mayor parte del presupuesto global de medicamentos. En cuanto a la inversión del área de investigación y desarrollo, el mayor enfoque sigue siendo hacia los productos oncológicos. Las compañías que seguirán a la cabeza son: Roche, Celgene, Bristol Myers Squibb, Johnson & Johnson, Pfizer, AstraZeneca, Merck, Novartis, Abbvie y Astellas.
Con base en un estudio realizado por Clarivate, se encontraron 15 medicamentos potenciales para 2023. Su estudio se fundamenta en la experiencia de más de 160 analistas que cubren cientos de enfermedades, medicamentos, mercados y conjuntos de datos integrados que abarcan el ciclo de vida de investigación y desarrollo, así como la comercialización y otras fuentes de la industria como comunicados de prensa, presentaciones y publicaciones revisadas por pares de compañías biofarmacéuticas. Dentro de los medicamentos propuestos, enlistados por padecimiento, están:
Psoriasis:
Bimekizumab (BIMZELX) es una inyección subcutánea a base de anticuerpos monoclonales de UCB. Es el primer inhibidor dual IL-17A, IL-17F, en los estudios de fase 3 se observa un mejor impacto que los tratamientos actuales con una menor dosis. En 2021, se aprobó en Europa, en 2022 en Japón y en 2023 será aprobado en Estados Unidos, esperando el vencimiento de su patente para 2027.
Deucravacitinib, de BMS, se aprobó en 2022 por la FDA y en 2023 será lanzado en Europa. Se espera el vencimiento de patentes hasta 2033.
Cáncer:
Capivasertib, de AstraZeneca, para ser administrado por vía oral en pacientes con cáncer de mama con RH positivo y cuyo vencimiento de patente se espera para el 2028.
Teclistamab, de Janssen, que se administra una vez al mes de manera subcutánea. Es un activador de células T CD3 dirigido por BCMA biespecífico que se usa para tratar algunas formas de mieloma múltiple y es el primero de su clase que se aprobó a fines de 2022 por la FDA y cuyas patentes se espera empiecen a vencer para 2036.
Enfermedad del riñón:
Daprodustat, de GSK, de administración oral para el tratamiento de enfermedad crónica del riñón que se aprobó en 2020 en Japón y este año será aprobada en Estados Unidos.
Sparsentan, de Travere Therapeutics, es una molécula que funciona como antagonista de los receptores de endotelina tipo A (ETA) y angiotensina II subtipo 1 (AT1). Se espera sus patentes comiencen a vencer para 2030.
Enfermedad de Parkinson:
Foscarbidopa / foslevodopa, de AbbVie, sería la primera infusión subcutánea carbidopa/levodopa en el mercado que podría ser una mejor alternativa para los pacientes, cuya patente se esperaría para 2039.
Alzheimer:
Lecanemab, de Eisai Co Ltd y Biogen, y Donanemab, de Eli Lilly, que ofrecen una mejor alternativa vs. aducanumab, y cuyas patentes se espera vencimiento para 2025 y 2031.
VIH:
Lenacapavir, de Gilead Sciences. Su impacto se debe a que tiene una ventaja competitiva debido a su administración de únicamente dos veces al año, además de tener una menor toxicidad gastrointestinal, así como menos interacciones fármaco-fármaco.
Enfermedad de Crohn:
Mirikizumab, de Eli Lilly, anticuerpo monoclonal, el primero para colitis cuya patente podría vencer en 2034.
Hemoglobinuria paroxismal nocturna (PNH) y atrofia geográfica (GA)
Pegcetacoplan, de Apellis Pharmaceuticals, inhibidor del complemento C3 es una infusión subcutánea que se aplica dos veces por semana para el tratamiento de PNH y se aplica una vez al mes o cada dos meses intravítrea para tratar GA. Se espera que su patente empiece a vencer a partir de 2033.
Alopecia
Ritlecitinib, de Pfizer, se utiliza administrado de manera oral para el tratamiento de la alopecia. Es el único inhibidor JAK3 (Janus quinasa) y TEC. Se ha estudiado su eficacia en la dosis de 30 mg y se está investigando seguridad y eficacia a 50 mg. Se espera su lanzamiento en Estados Unidos en 2023 y en Europa el año próximo, mientras que el vencimiento de sus patentes se espera para 2039.
Diabetes
Teplizumab, de Probention Bio, es el primer tratamiento de inmunoterapia para la diabetes tipo 1 que tiene la finalidad de preservar la función de las células beta y retardar la necesidad de insulina. Fue aprobado en 2022 y se espera empiecen a vencer sus patentes para 2026.
Hemofilia
Valoctocogene, de BioMarin Pharmaceutical, es un medicamento de terapia génica que expresa la variante SQ del factor de coagulación humano VIII.
Nuevos tratamientos, como la terapia celular y génica, así como la tecnología de vacunas de RNAm, han aumentado del 11 al 21% de la línea de desarrollo de fármacos, lo que implica el mayor crecimiento visto en el sector. Este cambio podría generar una mayor fragmentación de la tecnología, nuevas cadenas de suministro y ciclos de vida de producto únicos.
Por QFB Nadia Martínez












