La esencia de la transferencia de tecnología (TT) consiste en mover un producto de la fase de concepción para la manufactura en escala industrial de manera segura, con calidad y eficacia. Todos los esfuerzos conllevan a plasmar en el producto el perfil de calidad deseado (quality target product profile - QTPP), además del conocimiento adquirido en innovación, tecnología, elección de fabricantes y proveedores de materiales con los hallazgos que empalman ciencia y experimentos en la realidad industrial del sitio de manufactura.
Introducción
En 2022, por medio del reporte 56 (TRS 1044, anexo 3(1)), la Organización Mundial de la Salud (OMS) publicó la guía para transferencia de tecnología en manufactura farmacéutica que establece el lineamiento básico para este importante paso en el ciclo de vida de productos con impacto en la salud humana y que sirvió de guion para este artículo.
Como indica la Conferencia Internacional para Harmonización (ICH) en su documento Q12 (2) acerca de la consideraciones técnicas y regulatorias, la gestión del ciclo de vida de productos farmacéuticos comprende 4 etapas, resumidos en la figura 1: (i) desarrollo, (ii) transferencia, (iii) fabricación en larga escala, y (iv) descontinuación.
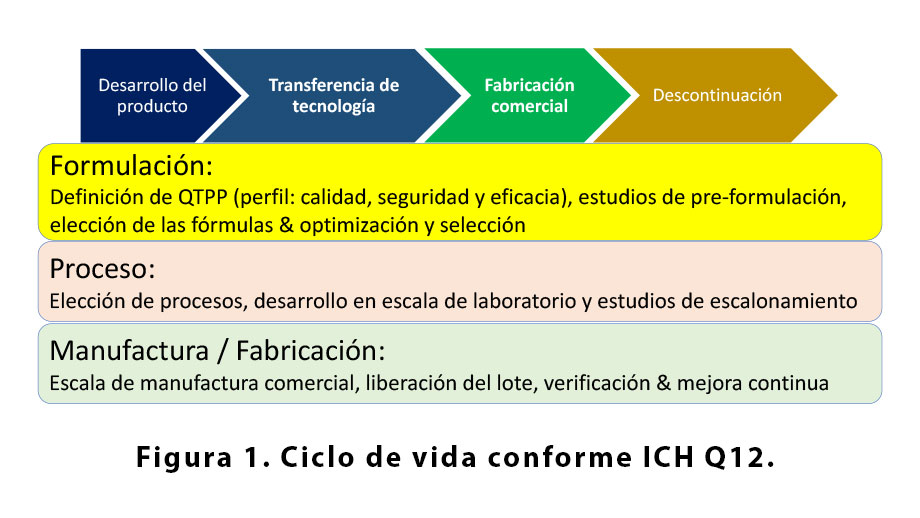
Transferencia presume que existe una organización que posee la información, aquí llamada de SU (en inglés, supplying or sending unit) y otra organización que recibe la información, aquí llamada de RU (en inglés, receiving unit). En algunos casos puede existir una tercera entidad, contratada por SU o RU para facilitar la transferencia, sea para actividades de manufactura, control o gestión.
El nivel de desarrollo de tecnología alcanzado por SU impacta directamente el número de lotes y el tiempo necesario para completar de manera eficaz la transferencia. La industria de productos para la salud humana empieza a seguir los niveles de preparo para la TT propuestos para otras industrias, como NASA’s TRL(3) (en inglés technology readiness level) que contempla nueve fases: (i) concepto básico de la tecnología (revisión de literatura científica y principios básicos estudiados y documentados); (ii) investigación y prueba de concepto (ideas y protocolos); (iii) desarrollo (ensayos, pruebas, experimentos críticos y caracterización de los insumos principales); (iv) seguridad de la formulación (pre-formulación y estudios de laboratorio); (v) demostración (prototipos, formulación y lotes piloto en sistema industrial, diseño de experimentos como soporte para iniciar el registro del producto); (vi) desarrollo del sistema (demostración en escala industrial, lote mínimo, verificación del espacio de diseño); (vii) operación en ambiente operacional (lotes mínimo y máximo); (viii) producto ya disponible en el mercado (sistema calificado y producto aprobado por la autoridad regulatoria); y (ix) operación de rutina (soporte por tecno o farmacovigilancia, revisión periódica de la calidad del producto y desempeño del proceso).
La búsqueda bibliográfica indicará varias sugerencias de actividades para transferencia. El punto de partida es investigación y desarrollo (I+D) que puede avanzar para la manufactura en un mismo sitio, de matriz a subsidiarias, o de organizaciones I+D para recipientes externos en varios continentes.
Fases del proyecto de transferencia de tecnología
Cuatro fases son planteadas en la guía de la OMS (TRS 1044(1)), a saber: (I) iniciación, (II) planeación, (III) ejecución, y (IV) revisión y conclusión.
- Iniciación
Se identifica la necesidad de TT, e.g., lanzamiento de nuevo producto, manufactura con insumo altamente activo, etc., o por capacidad productiva. Además de las actividades dentro de una misma organización, se evalúan empresas con potencial para recibir la tecnología respeto a aptitud, capacidad (cantidades), capabilidad (tecnología y calidad), además de viabilidad logística y económica.
- Planeación
El personal técnico de SU y RU, con base en el nivel de esfuerzo de cada equipo de profesionistas, prepara el plan de transferencia. La planeación incluye, pero no se limita, a insumos, documentación y criterios de calidad (especificaciones, muestreo, métodos de trabajo y análisis, criterio de aceptación y límites de alerta & acción).
I+D ya debe de haber verificado los riesgos potenciales desde el punto de vista de materiales, procesos y producto. Para alcanzar consistencia, todas las posibles fuentes de variabilidad deben ser identificadas, explicadas y establecer maneras de manejarlas (4). En el artículo anterior presentamos cómo los laboratorios de I+D realizan los estudios iniciales para una formulación exitosa (5). Protegidos por contrato de confidencialidad, SU comparte la parte abierta del expediente de insumos (drug master file o DMF) e histórico del producto (product history file o PHF), formula cuali- y cuantitativa, descripción del producto, métodos de manufactura, control en proceso y empaque, además de aspectos de seguridad y manejo de materiales, intermediarios o granel y producto. Con los detalles del proceso y la evaluación de riesgos se revisan los requerimientos de protección (ambiental, operadores y producto) bien como el tratamiento de residuos (sólidos, líquidos y volátiles). Los equipos de SU y RU revisan los detalles para instalaciones, equipos, ensayos y procesos, incluyendo los parámetros críticos de proceso, puntos críticos de control y espacio de diseño (caso se aplique). En esta etapa, SU y RU revisan los respectivos reportes de validación, estabilidad, revisión periódica de sistemas críticos, instalaciones, producto y otras partes relevantes.
- Ejecución
Amparado por el resultado de las fases anteriores, SU verifica la necesidad de calificación o validación de los elementos de soporte de RU antes de iniciar la transferencia de métodos de análisis y calificación del personal asignado para el proyecto. En esta fase se cierran las brechas detectadas en instalaciones, equipos, métodos, sistema de calidad incluyendo liberación de partes o producto e impacto del producto nuevo en los procedimientos de limpieza entre productos, áreas y equipos compartidos o entre lotes del producto, en caso de áreas y equipos dedicados.
Si no se pudo cerrar las brechas sólo con lo que SU y RU pueden proveer, se evalúa la necesidad y nivel de esfuerzo para calificar soporte externo especializado, e.g., manufactura de intermediarios, soporte técnico o analítico.
En esta fase es donde la experiencia de SU y la transparencia de las operaciones unitarias por RU facilitan la exitosa realización de la TT. En nuestra experiencia, sumada a los avanzos en digitalización e integración de captura de datos, la labor de los expertos de SU se hace importante para tomar decisiones rápidas y efectivas. Las fases anteriores prepararon el camino para obtener información precisa y exacta, en tiempo, sin influencia, incerteza, sesgue, preferencia u otro elemento que aumente la complejidad de cada evento. Los procedimientos para registros, verificación y liberación de cada operación unitaria son fundamentales para que la TT sea completada conforme planeado.
- Revisión y conclusión
Al final de cada lote de la TT, se comparan los resultados de los atributos críticos de proceso y calidad con el planeado, se hacen ajustes o cambios para el lote siguiente, conforme la situación, se recolectan las unidades de retención y se inicia el programa de estabilidad.
Completados todos los lotes planeados para la TT, se documentan las conclusiones y recomendaciones de los reportes individuales y se prepara el reporte final. También SU indicará la frecuencia para verificación de continuidad y compromisos entre SU y RU.
A partir de este punto, conforme el acuerdo de calidad que formó parte del contrato entre SU y RU, se pone en práctica la comunicación acerca reclamaciones (eficacia y calidad), cambios planeados o disparados por asuntos regulatorios, de proveedores o de mercado, revisión periódica de la calidad del producto y desempeño del proceso conforme el planteado en el sistema de calidad farmacéutica ICH Q10(6) y ciclo de vida del producto ICH Q12(2).
Paso a paso
Los 17 pasos presentados en la figura 2 reflejan las cuatro fases descritas anteriormente y el planteamiento de la guía TRS 1044 de la OMS para transferencia de tecnología. SU y RU pueden utilizar secuencias alternativas que lleven a la conclusión satisfactoria del proceso.
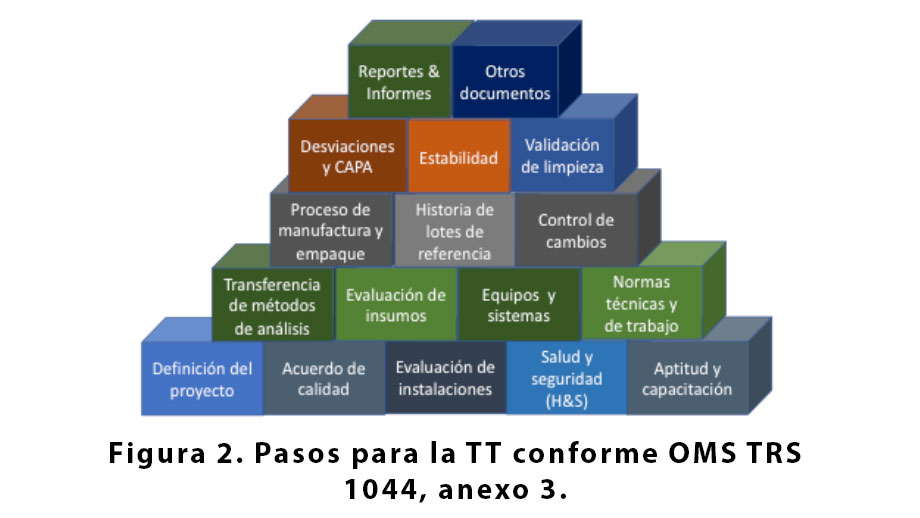
El avance de la TT toma por base los pasos de definición del proyecto, elaboración del acuerdo de calidad entre SU y RU observando las leyes y los reglamentos del país que recibe la TT, evaluación previa de las instalaciones para verificar el grado de preparación especialmente en el renglón de protección contra contaminación cruzada, salud de los obreros y protección del medio ambiente(8),(9),(10). En estos pasos se evalúa el grado de aptitud y capacitación del personal de RU, desde almacenes hasta garantía de calidad para recibir la TT.
Una vez firmados los acuerdos comerciales y de calidad, y comprobada la capacidad física de instalaciones y equipos, capabilidad de procesos y capacitación del personal, se pasa a evaluar y ensayar insumos, comprobar el nivel operacional de instalaciones, equipos y sistemas para revisar las normas técnicas y de trabajo que impactan la TT. SU verifica la compatibilidad de los equipos, instalaciones y flujo de trabajo de RU para el proceso o producto y de común acuerdo resuelvan las eventuales brechas.
Completados los pasos generales, SU avanza al específico compartiendo detalles de procesos de manufactura y empaque, historia de todos los lotes ya fabricados desde la escala de laboratorio hasta lotes piloto o bio-lotes, bien como los cambios que hicieron parte del progreso hasta la fecha. La historia incluye, sin estar limitada, a partes abiertas del drug master file (DMF) y device history record (DHR), o sus equivalentes.
SU enviará muestras de varios lotes ya fabricados para análisis por RU. La comparación de los resultados de RU con el certificado de análisis (CofA) o de conformidad (CofC) seguidos de evaluación estadística indicará si el error analítico es compatible con la expectativa de SU. Caso no satisfaga, RU y SU deben investigar la causa probable y tomar acciones correctivas y preventivas.
Es parte de la TT que SU y RU elaboren acuerdos respeto a marcos regulatorios que impactan tanto el país de origen de la TT como el país donde el producto será manufacturado y comercializado. En este paso están ubicados los estudios especiales de estabilidad, sea en condiciones de almacenaje, transporte y dispensación, sea en condición acelerada o estrés, o bien, varios ciclos entre cadena fría y ambiente, conforme necesario.
Una vez definidas las instalaciones, equipos e instrumento a usar, es parte de la TT validar los métodos de limpieza. Para obtener éxito, SU provee, además de información pública que se encuentra en las fichas de información de seguridad (SDS) acerca del activo y excipientes, los datos obtenidos en las fases de desarrollo hasta el momento. Hacen parte de este paso, métodos, agentes de limpieza, técnicas de muestreo, límites de detección (LOD) y cuantificación (LOQ). Muestreo de insumos, intermediarios, producto final o para evidenciar limpieza es parte fundamental para la calificación de desempeño (PQ) y ya fue tratado en artículo anterior (11).
El protocolo de la TT debe establecer instrucción clara e inequívoca para que RU consulte con SU respeto a cambios anunciados (e.g., instalaciones, equipos, personal clave, procesos de síntesis para IFAs o excipientes, etc.) o no anunciados (desabastecimiento de materiales o limitaciones del fabricante calificado ocasionadas por actos de la naturaleza, guerras, pandemias, etc.).

Reportes e informes
La fecha de validad de un producto, mismo que es establecido inicialmente según la guía de TRS 1010 de OMS (12), necesita ser confirmado por lotes fabricados en el sitio que recibe la TT. Es recomendable que los primeros lotes sean sometidos a condiciones de estrés, largo plazo, intermediaria y acelerada para asegurar que el producto se mantendrá estable conforme la aprobación inicial, que por lo general es de 24 meses. Tiempos más largos necesitan evidencia científica documentada para atributos de calidad físicos, químicos y microbiológicos.
La sugerencia es que todos los reportes y datos crudos sean mantenidos en la central de documentación de RU y sólo copias autorizadas o acceso limitado para lectura de documentos electrónicos sean disponibles para resguardar la integridad de datos.
La retención de reportes e informes debe atender las leyes y reglamentos locales además del acuerdo entre SU y RU. Entre los reportes e informes se encuentran el histórico de lotes piloto, “bio-batches” usados para ensayos clínicos y/o registro o lotes de la TT, protocolos y reportes de “hold time” no contemplados en los estudios de SU, histórico y gestión de cambios, reclamaciones, investigaciones de desvíos y lotes retirados del mercado.
Toda documentación propiciada por SU debe estar sostenida con referencias aceptadas por la comunidad científica. La documentación incluye instrucciones para manufactura, plan de riesgos, parámetros críticos de proceso, atributos de calidad para insumos, granel o productos intermediarios, métodos de muestreo y análisis, limitaciones para uso del volumen útil de equipos, tiempo de espera (hold time) y todo el conocimiento adquirido acerca de cada paso del proceso obtenido en la manufactura de lotes de laboratorio, pruebas de concepto, diseño de experimentos y validación del proceso (13).
Cuando la TT es realizada dentro de una misma empresa y en el país, la necesidad de documentos adicionales está restricta a la relación entre SU y RU. La necesidad se amplía en el caso de la TT entre matriz y subsidiaria ubicada en países diferentes y sujeta de leyes y reglamentos específicos. La necesidad se amplía más todavía cuando la TT es entre empresas diferentes, e.g., SU es una organización de manufactura contratada (CDMO o CMO).
Entre los documentos básicos se encuentra el contrato de confidencialidad. Los adicionales incluyen, sin estar limitados a, derecho de propiedad intelectual, royalties o derechos de autor, acuerdos de precios o tarifación por el fornecimiento de insumos, costo por asistencia técnica y acuerdos acerca conflicto de intereses.
Conclusión
Presentamos la importancia y los beneficios de seguir una secuencia de pasos para la exitosa transferencia de tecnología. Su implementación requiere ordenar adecuadamente las actividades, desde la concepción del proyecto hasta el monitoreo en fase industrial del producto o método transferido.
La experiencia enseña que lo que está presentado en las guías es perfectamente aplicable, utiliza eficientemente los recursos y permite avanzar con confianza de investigación y desarrollo hasta la liberación de lotes para el consumo.
La divulgación, capacitación y ejecución de las guías son tareas que requieren sinergia entre academia, industria y órganos de reglamentación para capacitar a profesionales en la aplicación de gestión de tecnología farmacéutica en beneficio de la población, industria y economía del país.
Por: Humberto Zardo*
* Candidato a Doctor en Ciencias (Fármaco y Medicamentos) por la Universidad de S. Paulo, Brasil. Realizó transferencia de tecnología por más de 20 años en las Américas, Asia, Europa, África y Oriente Medio.
Referencias:
- WHO. WHO World Health Organization TRS 1044, 56th report. Geneva; 2022. Licence: CC BY-NC-SA 3.0 IGO. WHO Expert Committee on Specifications for Pharmaceutical Preparations; 2022.
- ICH Q12: Technical and regulatory considerations for pharmaceutical product lifecycle management, step 4, 20 Nov 2019. ICH; 2019.
- Banke J. Technology Readiness Levels Demystified, NASA. 2010.
- Piai S, Giguashvili N. Innovating Pharma at the edge. Improving performance, quality, and compliance. IDC#EUR 149781722; 2022.
- Zardo H, Issa MG, Daniel JSP, Ferraz HG. Calidad Predictiva: Una Introducción. enFarma. 2021; Edición Especial de Manufactura:30-3.
- ICH Q10 - Pharmaceutical Quality System. ICH; 2008.
- Zardo H. Transferencia de Tecnología de Procesos de Manufactura en la Industria Farmacéutica. Diplomado de Validaciones; 2022 jul 19; Lima, Peru.
- Zardo H. Gestión de riesgos en la industria farmacéutica su importancia y aplicación. Farma Cosmet. 2019;5:14-20.
- Zardo H, Tomazzini A, Fernandes AM, Bastos A. Plano de risco – Importância do desenho conceitual de plantas farmacêuticas. Contract Pharma Bras. 2015;7:14-7.
- ICH Harmonised Tripartite Guideline - ICH Q9 Quality Risk Management. International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use; 2005.
- Zardo H. Muestreo y su impacto en las decisiones. enFarma. 2018;Ediciíon Especial Ambientes Controlados:42-4.
- USP <1010>. Analytical data - interpretation and treatment.
- Alonso P. MJ. El nuevo enfoque de la validación de procesos: verificación continuada del proceso durante el ciclo de vida. Farma Cosmet. noviembre de 2019;5:10-2.












