Harold A. Prada-Ramírez, Sandra Celeita y Juan Camilo Fonseca,
de Laboratorios Coaspharma S.A.S., CL 18A 28A-43, Bogotá, Colombia.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Resumen
El objetivo principal de esta investigación es validar el desempeño de un método alternativo de microbiología rápida para detectar y cuantificar hongos y levaduras, utilizando matrices farmacéuticas tanto en producto terminado como en materia prima. A través de la construcción de curvas de calibración específicas para cada producto validado se estableció una correlación entre los datos cuantitativos del método tradicional de conteo en placa (UFC) con los datos cuantitativos del método alternativo de microbiología rápida (tiempos de detección, TD). Se utilizaron las herramientas estadísticas de chi-cuadrado, coeficiente de correlación (CC), coeficiente de determinación R2 y la prueba de bondad de ajustes para establecer una asociación estadísticamente significativa entre las variables producidas por ambas metodologías (TD vs. UFC). Así, siguiendo las directrices del capítulo 1223 de la USP se demostraron criterios esenciales para validar un método cuantitativo tales como linealidad, rango operativo, equivalencia de resultados, exactitud, especificidad, precisión, robustez operativa, tolerancia, límite de detección y cuantificación. Los resultados obtenidos en esta investigación ponen de manifiesto una congruencia estadística entre ambas metodologías, por tanto, el método alternativo propuesto se puede utilizar para detectar y cuantificar hongos y levaduras de manera precisa y exacta en artículos farmacéuticos.
Introducción
La aplicación de métodos microbiológicos alternativos (MMA) ha ido creciendo en las últimas décadas, impulsada por los nuevos avances tecnológicos (1). Las autoridades reguladoras de la salud de todo el mundo han estado incentivando a los fabricantes de productos farmacéuticos a utilizarlos, ya que ofrecen beneficios en la ejecución, automatización al igual que mejoran la exactitud, sensibilidad, precisión y reducen el tiempo del proceso microbiológico en comparación con los métodos tradicionales (1,2,3,4,5). Además, estos métodos exhiben un alto rendimiento y la capacidad de analizar una gran cantidad de muestras de manera simultánea, con resultados automatizados, lo que permite el análisis en tiempo real y la posibilidad de detección temprana de la contaminación (1,2,3,). De hecho, el uso de MMA está respaldado por muchos documentos oficiales utilizados como guía de validación (5,6). El informe técnico de la WHO (World Health Organization) fomenta el uso de métodos microbiológicos rápidos como reemplazo de los métodos convencionales si se realiza la validación adecuada para el método de la farmacopea (USP). Del mismo modo, todas las farmacopeas en sus últimas versiones promueven su uso como métodos de detección, ofreciendo guías para su implementación en la industria (5,6). Las farmacopeas europea y británica, por ejemplo, reconocen nuevas posibilidades que permiten implementar los métodos de microbiología rápida para tomar acciones correctivas antes que los métodos convencionales, que generalmente son lentos (1,3,5,6).
A pesar de la amplia adopción de los métodos microbiológicos rápidos en la industria alimentaria (7,8,9,10,11,12), éstos están completamente inexplorados en la industria farmacéutica porque están sujetos a estrictas limitaciones regulatorias que incluyen una especificación de liberación microbiológica más estricta y normalmente demandan mucho tiempo para su validación, siendo éstas las principales barreras para su adopción (1,2,3,5). Por lo tanto, la inclusión de un MMA como parte de un acuerdo industrial siempre implica el riesgo de retraso en su aprobación (1,3,5). Debido a esto, la realización de una validación robusta es esencial para ayudar a facilitar a la industria farmacéutica la implementación de tales tecnologías.
En la industria farmacéutica, el proceso microbiológico que causa mayor retraso para la salida al mercado del producto terminado (PT) y materias primas (MP) es el conteo total de hongos y levaduras, ya que como se describe en el capítulo de la USP, esta evaluación microbiológica normalmente toma de cinco a siete días, mientras que el recuento microbiano aerobio total suele demorar de tres a cinco días (13,14). El método de validación propuesto en el presente trabajo pretende reducir el tiempo del proceso microbiológico para el recuento de hongos y levaduras de cinco a siete días, como suele tardar el método estándar de referencia, a dos días (48 horas) utilizando el MMA. Por lo tanto, la evaluación microbiológica para las matrices farmacéuticas analizadas se pretende realizar en tres días para el recuento microbiano aerobio total y análisis de patógenos como E. coli (usando el método convencional), y dos días para el recuento total de hongos y levaduras (usando el sistema Soleris®) (1,3). Este hecho convierte a esta tecnología en un candidato prometedor para reemplazar el método tradicional de conteo en placa (MTCP) para el análisis de hongos y levaduras.
Adicional a las bondades de disminuir los tiempos de análisis microbiológicos, este es un método operativamente amigable que permite que los análisis rutinarios sean mucho más eficientes, puesto que, a diferencia del MTCP, no es necesario preparar medios de cultivo, porque los viales Soleris® ya vienen listos para su uso (1,3,5). Adicionalmente, el equipo genera informes automatizados con la trazabilidad requerida para evaluar todo el proceso, evitando la lectura y transcripción manual de resultados por parte de equipo humano (analistas), disminuyendo tiempos de tareas manuales de rutina y eliminando el riesgo de generar errores humanos (1,3,5). Teniendo en cuenta que es un sistema automatizado, permite el registro en línea de los datos, monitoreo de las condiciones de incubación y crecimiento in vivo, el uso de notificaciones automáticas y/o alertas tempranas para muestras fuera de especificación y todos los demás ítems de trazabilidad que incluyen el control de usuarios, número de análisis, consecutivo de microbiología, lote del producto, proveedor, lote del vial Soleris® utilizado, consecutivo del medio utilizado en la siembra, fecha y hora del análisis, resultados en tiempos de detección (TD) y su respectivo equivalente en UFC permitiendo tener una mayor trazabilidad e integridad de datos (1,3,5).
Es de amplio conocimiento que la matriz farmacéutica es un factor importante para los resultados de validación. En el presente estudio, se seleccionaron cuatro productos farmacéuticos terminados (diclofenaco sódico gel 1%, clobetasol propionato 0.05% crema, alginato 5.0 g bicarbonato 2.13 carbonato 3.25 g/100 mL suspensión oral, guayacolato de glicerilo (guaifenesina) 200 mg + bromhexina clorhidrato 80 mg) y tres materias primas (glicerina USP, sorbitol al 70% no cristalizable y propilenglicol). Los PT y MP seleccionadas para llevar a cabo esta investigación son las matrices farmacéuticas con mayor número de lotes producidos en Coaspharma S.A.S. debido a su alta demanda comercial. Por lo tanto, la reducción de los tiempos de análisis microbiológicos ayudaría a lanzar el producto mucho más rápido al mercado, reducir los costos de almacenamiento, mejorar la eficiencia en el control de inventario y aumentar la capacidad de respuesta rápida ante resultados microbiológicos adversos. A su vez, al acelerar la liberación del producto al mercado disminuirá de manera significativa la susceptibilidad a sanciones económicas por incumplimiento de entrega del producto a los respectivos clientes. Al ser un sistema integrado y automatizado, también requiere menos mano de obra, lo que permite el registro de mediciones en línea y el monitoreo microbiano en tiempo real y garantiza la integridad de los datos y la trazabilidad del análisis (1,2,3,4).
En estudios preliminares llevados a cabo en el laboratorio de microbiología de Coaspharma S.A.S. se validó el método alternativo de microbiología rápida basado en el crecimiento automatizado para la detección de hongos y levaduras utilizando como matriz farmacéutica una suspensión oral antiácida (1). En esta validación se demostraron todos los criterios exigidos por la USP vigente capítulo 1223 para validar un método alternativo cuantitativo (1,2,3). Estudios semejantes también realizados en nuestro laboratorio pusieron de manifiesto la eficacia de esta metodología para cuantificar hongos y levaduras a partir de productos de cuidado personal, a su vez, se demostró su eficacia para detectar bacterias formadoras de biopelículas en los sistemas de distribución de agua tales como el complejo Burkholderia cepacia (2,3). Por tanto, el presente trabajo es una extensión de las tres publicaciones previamente descritas para demostrar el amplio espectro de productos que se pueden analizar por esta metodología alternativa.
De acuerdo con los lineamientos dados en la USP vigente capítulo 1223, una vez que un MMA ha demostrado ser equivalente al MTCP, no es necesario demostrar la equivalencia de resultados para cada producto nuevo. Sin embargo, es indispensable demostrar que la aptitud del método funciona de manera idónea para la matriz farmacéutica objeto de estudio (4,5,6). De este modo, se pretende evaluar el desempeño de esta metodología en otros productos farmacéuticos de interés comercial para la empresa.
Utilizando matrices farmacéuticas tanto en PT como en MP posicionadas en el mercado por su alta demanda comercial, se validó nuevamente la tecnología Soleris® como sistema de crecimiento automatizado basado en variación óptica para la detección y cuantificación rápida de hongos y levaduras. Esta metodología se basa en el metabolismo microbiano, utilizando viales DYM-109C. El vial se divide en dos zonas: la parte superior de crecimiento destinada a la muestra y la parte inferior de lectura que contiene el “plug” de agar con un indicador (timolftaleína). El dióxido de carbono CO2 generado por el metabolismo oxidativo de levaduras y mohos se difunde de arriba a abajo hasta llegar al plug de agar (parte basal del vial DYM-109C). La zona de crecimiento y lectura del vial DYM-109C está dividida por una membrana que permite sólo la entrada de gases (6,7,8,9,10,11,12). De este modo, el dióxido de carbono y el agua forman ácido carbónico, bajando el valor de pH en la zona de lectura, es decir, del plug de agar. Esto conduce a un cambio de color con el tiempo (de verde a amarillo), que el software del equipo Soleris® detecta y registra automáticamente (6,7,8,9,10,11,12). Este cambio colorimétrico queda registrado como un tiempo de detección (TD) y representa el dato cuantitativo de la metodología (1,2,3,6,7,8,9). Vale la pena señalar que tanto el software como el hardware deben cumplir con los requisitos de buenas prácticas de laboratorio, junto con las pautas ofrecidas por la Asociación de Medicamentos Parenterales.
Para llevar a cabo la validación de la tecnología Soleris® se tienen que cumplir con varios requisitos esenciales que permitan demostrar la aplicabilidad de esta tecnología como reemplazo del MTCP. Dentro de dichos requisitos se encuentra la calificación de desempeño del equipo (calificación de instalación, calificación operativa y calificación de desempeño), la calificación del usuario (personal calificado), la aptitud del método para cada producto analizado previo a la validación por el método alternativo de microbiología rápida, la verificación y/o validación del método tradicional, validación del software Soleris® (cumplimiento de la CFR 21 apartado 11) la equivalencia de resultados (alternativo DT vs tradicional UFC) a través de la construcción de una curva de calibración, y la evaluación de un diseño experimental. Dicho diseño experimental permite darle un manejo estadístico a los datos obtenidos por ambos métodos con el fin de obtener criterios esenciales de validación como son: precisión, exactitud, linealidad, límite de cuantificación, límite de detección, rango operativo lineal, equivalencia de resultados y robustez.
Materiales y métodos
(a) Artículos farmacéuticos seleccionados
Se seleccionaron cuatro productos farmacéuticos terminados (PT) y tres materias primas (MP).
- Diclofenaco sódico gel 1% (PT).
- Clobetasol propionato 0.05% crema (PT).
- Alginato 5.0 g bicarbonato 2.13 carbonato 3.25 g/100mL suspensión oral (PT).
- Guayacolato de glicerilo (guaifenesina) 200 mg + bromhexina clorhidrato 80 mg (PT).
- Hidróxido de Aluminio 4% + Hidróxido de Magnesio 4% + Simeticona 0.4% (PT).
- glicerina USP (MP).
- sorbitol al 70% no cristalizable (MP).
- Propilenglicol (MP).
Para cada producto farmacéutico se seleccionaron tres lotes diferentes para llevar a cabo la recuperación de microorganismos tanto por el MMA como por el MTCP. Se utilizaron las cepas A. brasiliensis (Cat. No. ATCC 16404), C. albicans (Cat. No. ATCC 10231), Pseudomonas aeruginosa (Cat. No. ATCC 9027), Escherichia coli (Cat. No. ATCC 8739), Staphylococcus aureus (Cat. No. ATCC 6538), Salmonella typhimurium (Cat. No. ATCC 14028) y Bacillus subtilis (Cat. No. ATCC 6633) para llevar a cabo la validación.
(b) Método Alternativo de Microbiología Rápida. El instrumento Soleris® 128 y los consumibles fueron adquiridos de Catver S.A.S., representantes de Neogen Corporation en Colombia. Este sistema incluye cuatro incubadoras cada una de 32 viales con un control de temperatura preciso para cada cajón (28.5 °C ± 0,5 °C), software y computadora específicos para el equipo. La calificación de diseño (CD), la calificación de instalación (CI), la calificación operativa (CO) y la calificación de desempeño (CD) del sistema fueron cumplidas satisfactoriamente, tanto por el usuario como por el proveedor.
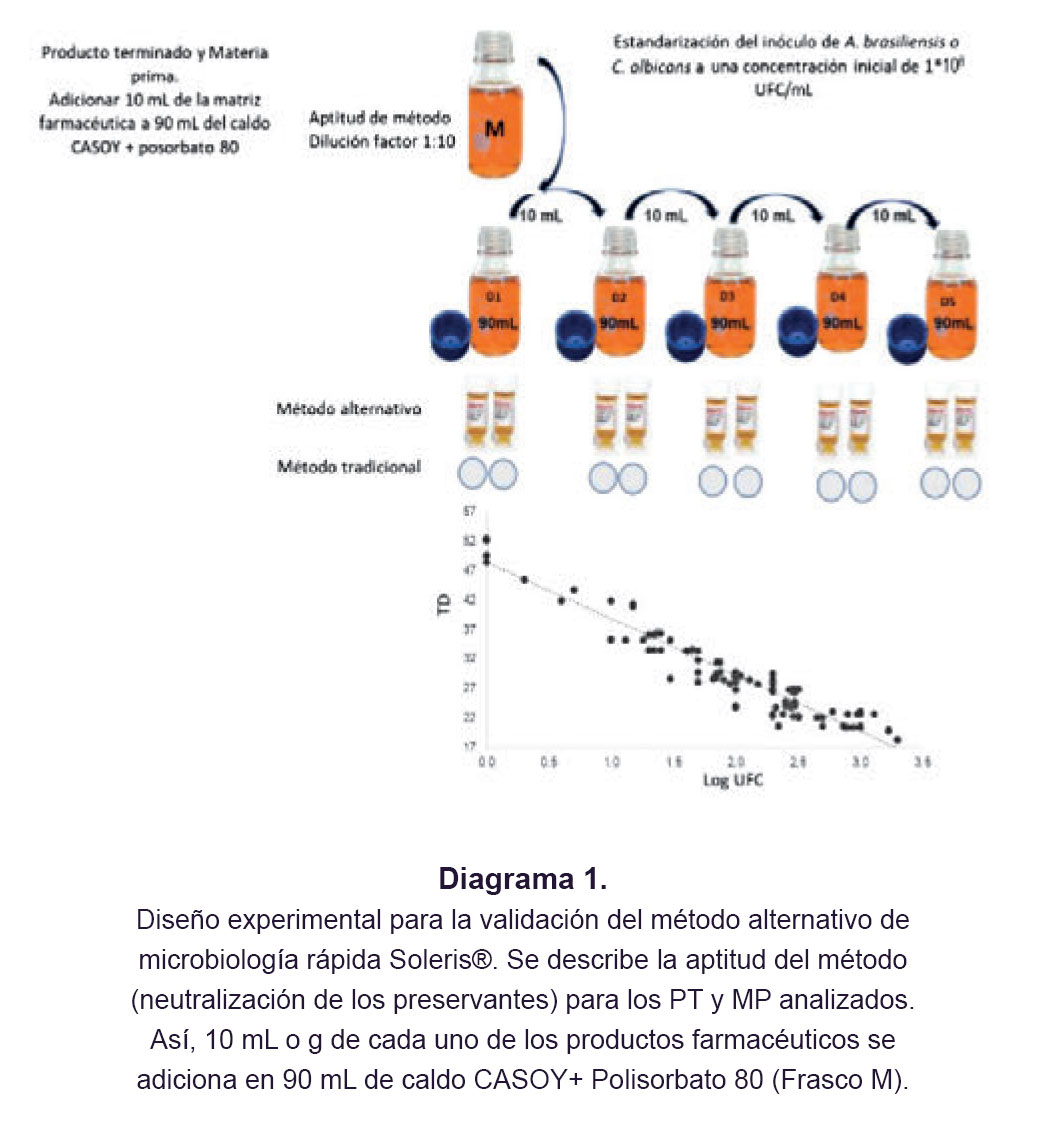
(c) Estandarización del Inóculo. C. albicans y A. brasiliensis se reactivaron a partir de stocks congelados en agar sabouraud y se incubaron durante 48 horas a 20–25 °C. Una vez finalizado el tiempo de crecimiento, se tomaron colonias aisladas y se resuspendieron en solución salina al 0.9% hasta alcanzar un estándar de McFarland de 2 (equivalente a 1,0x108 UFC/mL). A partir de este estándar de McFarland, se prepararon los inoculos de A. brasiliensis y C. albicans para usarlos como inóculo en la prueba de aptitud del método (Diagrama 1).
(d) Aptitud del Método y Curvas de Calibración. Se neutralizan químicamente los preservantes de los PT y MP analizados para obtener una determinación microbiológica exitosa. De este modo, se agregaron 10 g o 10 mL del respectivo producto farmacéutico en 90 mL de caldo CASOY en presencia del agente neutralizante seleccionado (Tween® 80). Posteriormente, se agregaron por separado 1 mL de C. albicans y A. brasiliensis tal y como se describe en el apartado de estandarización del inóculo (Diagrama 1). A partir de la aptitud del método se realizaron diluciones seriadas (D1- D5). De cada dilución (D1-D5), se inoculó 1 mL directamente en cada vial de DYM-109C y se incubaron durante 48 horas a 28.5 °C en el equipo Soleris®. Los viales se inocularon por duplicado (Diagrama 1). Simultáneamente, las placas de agar también se inocularon por duplicado con 1 mL en profundidad para cada dilución. Las placas se incubaron a 23.5 °C durante siete días. Esta serie de experimentos se realizó utilizando tres lotes diferentes para cada producto farmacéutico analizado. Se utilizó un vial de DYM-109C sin inocular como control negativo y un vial inoculado con 1 mL de la dilución (recuento de 10–100 UFC/mL) del pool de C. albicans / A. brasiliensis como control positivo. Cada TD registrado por el sistema Soleris® dentro del periodo de incubación (dos días), confirmado también por el cambio de color, fue una indicación de la presencia de microorganismos. Los datos generados tanto por el MMA como por el MTCP se trazaron en el software Minitab® versión 20.1.0.0 para generar curvas de calibración mediante el trazado de los TD en relación con los valores equivalentes de UFC (Diagrama 1). En promedio, la curva de calibración de cada PT y MP se construyó con un promedio de 60 datos contables provenientes de ambas metodologías.
(e) Linealidad y Equivalencia de Resultados. La linealidad es un criterio esencial de validación al momento de establecer equivalencia de resultados entre dos métodos que generan señales cuantitativas de diferente magnitud (UFC vs TD). La linealidad es la capacidad que tiene un método farmacopeico en generar una señal en proporción a la concentración de microorganismo. Existen distintos indicadores tales como el coeficiente de determinación y el coeficiente de correlación que permiten medir la relación entre dos métodos (tradicional vs. alternativo). De igual manera, existen herramientas estadísticas que permiten determinar de manera confiable la asociación entre dos variables, permitiendo establecer si las variables objeto de estudio son independientes o dependientes (1,2,3,4). La linealidad se determinó utilizando el modelo de prueba de bondad de ajuste y chi-cuadrado (x2) para evaluar la relación entre las UFC y los datos TD obtenidos.
(f) Exactitud. La exactitud, otro criterio esencial para validar un MMA, se fundamenta en determinar la proximidad de los resultados obtenidos por el MMA con los observados por el MTCP verificado y/o validado. Un indicativo de exactitud es que la capacidad de recuperación microbiana del MMA sea mayor al 70% de la observada por el MTCP. Así, utilizando la ecuación de la recta obtenida en la curva de calibración se determinaron las UFC del MMA a partir de los TD.
(g) Límite de Detección y Límite de Cuantificación. Para el MMA y el MTCP, el límite de detección (LDD) y el límite de cuantificación (LDC) se calculó a partir de la aptitud del método partiendo de las diluciones que permitían recuperar las concentraciones más bajas de microorganismo (<10 UFC). Para el MMA, los TD se convirtieron en UFC utilizando la ecuación de la recta derivada de la curva de calibración. Los valores de LDD y LDC para ambos métodos se establecieron utilizando la desviación estándar (DS) de las UFC determinadas a (<10 UFC) y la pendiente (m) de la curva de calibración obtenida para cada uno de los PT y MP analizados utilizando las ecuaciones LDD=3.3*DS/m y DC=10*DS/m. Los LDD y LDC de ambos métodos mostraron ser estadísticamente similares según la prueba de exactitud de Fisher (P > 0.05).
(h) Precisión y Tolerancia. Se utilizaron microorganismos frescos de C. albicans y A. brasiliensis, preparados como se menciona en la sección de estandarización del inóculo, para llevar a cabo la aptitud del método en presencia del producto utilizando tres lotes diferentes para cada uno de los PT y MP analizados. A partir de la aptitud del método, se realizaron diluciones seriadas. Posteriormente, los microorganismos se recuperaron en simultáneo y paralelo por el MTCP y el MMA, tal y como se menciona en el apartado de la curva de calibración (Diagrama 1). Para determinar la precisión se analizaron diluciones que recuperaron microorganismos en el rango de 10 a 100 UFC a través del MMA y MTCP para determinar la desviación estándar (DE) y el coeficiente de variación (CV) (22,23). Un MMA debe tener un CV que no sea mayor que el observado en el método de referencia, como se describe en USP <1223> (4,5,6).
(i) Especificidad. De acuerdo con la información del fabricante y como se describe en USP <1223 y 1225>, la especificidad por exclusión se define como la capacidad del método para excluir el crecimiento bacteriano (5,6). Se realizaron pruebas de especificidad en cinco bacterias patógenas comúnmente analizadas en la industria farmacéutica, Pseudomonas aeruginosa, Escherichia coli, Staphylococcus aureus, Salmonella typhimurium y Bacillus subtilis. A su vez, la especificidad por inclusividad se define como la capacidad del método para detectar una amplia gama de cepas que pertenecen al organismo objetivo (26). En el caso del DYM-109C, el panel de inclusividad se llevó a cabo utilizando A. brasiliensis y C. albicans como representantes de hongos y levaduras.
(j) Robustez Operativa de equipo de microbiología rápida. De acuerdo con el capítulo 1225 de la USP la robustez de un procedimiento analítico es una medida de su capacidad para no ser afectado por variaciones pequeñas, aunque deliberadas, en los parámetros del procedimiento indicados en la documentación, y provee una indicación de su aptitud durante condiciones normales de uso. La robustez puede determinarse durante la etapa de desarrollo del procedimiento analítico. Así, con el propósito de generar un entendimiento más profundo en cuanto a la robustez operativa, se realizaron variaciones en las temperaturas, parámetros de detección (Threshold) y tiempos de incubación, utilizando como matriz farmacéutica la suspensión oral antiácida (hidróxido de aluminio 4% + hidróxido de magnesio 4% + simeticona 0.4%).
Resultados y Discusión
Aptitud del Método: Neutralización de los Preservantes Farmacéuticos
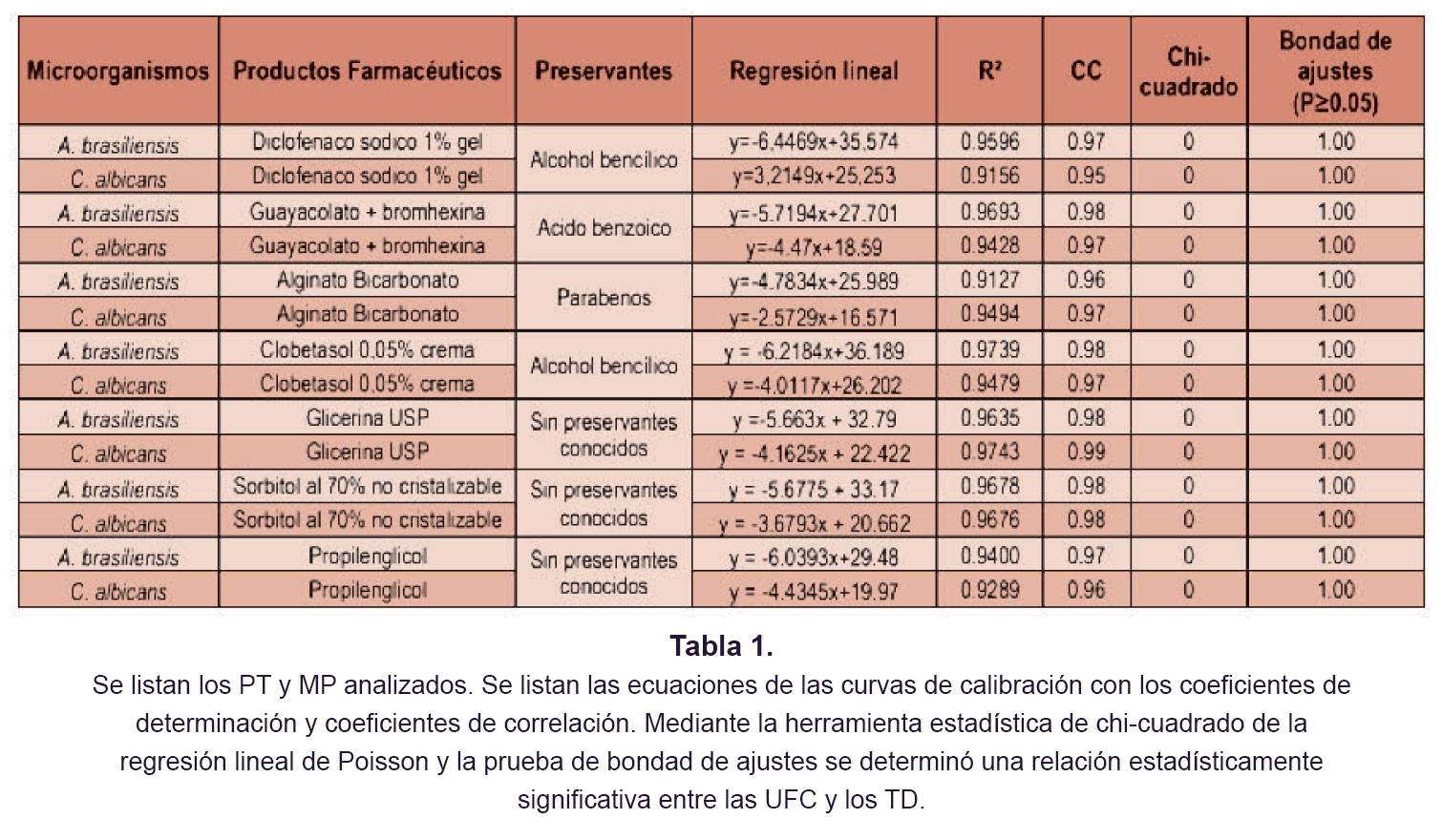
Se realizó la supresión de la actividad antimicrobiana para todos los PT y MP analizados, y posteriormente se realizó la recuperación de C. albicans y A. brasiliensis en forma paralela y simultánea mediante el MTCP y MMA. Para evaluar la aptitud del método para cada uno de los PT y MP analizados, se utilizó polisorbato (Tween® 80), un compuesto altamente etoxilado, para neutralizar químicamente la actividad de los preservantes farmacéuticos. Todos los productos analizados por microbiológica rápida Soleris® fueron previamente validados por el método tradicional de conteo en placa, garantizando que para los PT y MP analizados se podría llevar a cabo de manera eficiente la supresión de los preservantes o compuestos con actividad antimicrobiana (ver Tabla 1). Esta recuperación de microrganismos en paralelo y en simultaneo permitió la construcción de las curvas de correlación (TD vs Log UFC).
Aptitud del método: Diclofenaco sódico 1% gel
El Diclofenaco Sódico 1% Gel utiliza dentro de su fórmula maestra alcohol bencílico. El modo de acción de los alcoholes se fundamenta en aumentar la permeabilidad de la membrana celular bacteriana, ocasionando lisis microbiana (3). En la aptitud del método se utilizó el Polisorbato 80 (0.1%) para neutralizar al alcohol bencílico presente en la formulación del Diclofenaco Sódico 1%. Esta neutralización funcionó de manera óptima ya que permitió recuperar tanto C. albicans como A. brasiliensis inoculados durante la aptitud del método (neutralización del preservante) por el MTCP y por el MMA (% de recuperación ≥ 70%) (ver tabla 1). Esta recuperación de microrganismos en paralelo y en simultaneo permitió la construcción de las curvas de correlación (TD vs Log UFC).
Aptitud del método: Guayacolato de glicerina (guaifenesina) 200 mg + bromhexina clorhidrato 80 mg
El Guayacolato de glicerina (guaifenesina) 200 mg + bromhexina clorhidrato 80 mg se utiliza como un expectorante que utiliza dentro de su fórmula maestra, ácido benzoico y benzoato de sodio. El modo de acción antimicrobiano de los ácidos radica en disminuir el pH citoplasmático alterando procesos celulares esenciales como la glucólisis (3). En la aptitud del método se utilizó el Polisorbato 80 (0.1%) para neutralizar al ácido benzoico y al benzoato de sodio presente en la formulación del PT. Esta neutralización funcionó de manera óptima ya que permitió recuperar tanto C. albicans como A. brasiliensis inoculados durante la aptitud del método (neutralización del preservante) por el MTCP y por el MMA (% de recuperación ≥ 70%) (ver tabla 1). Esta recuperación de microrganismos en paralelo y en simultaneo permitió la construcción de las curvas de correlación (TD vs Log UFC).
Aptitud del método: Alginato 5.0 g bicarbonato 2.13g carbonato 3.25/100 mL suspensión oral
El Alginato 5.0g bicarbonato 2.13g carbonato 3.25g/100 mL suspensión oral utiliza dentro de su fórmula maestra metilparabeno y propilparabeno como preservantes activos del producto, cuyo efecto preservante está dirigido principalmente hacia hongos y levaduras (3). En la aptitud del método se utilizó el Polisorbato 80 (0.1%) para neutralizar al metilparabeno y el propilparabeno presente en la formulación del Alginato 5.0 g bicarbonato 2.13 g carbonato 3.25 g/100 mL suspensión oral. Esta neutralización funcionó de manera óptima ya que permitió la recuperación de C. albicans y A. brasiliensis inoculados durante la aptitud del método (neutralización del preservante) por el MTCP y por el MMA (% de recuperación ≥ 70%) (ver tabla 1). Esta recuperación de microrganismos en paralelo y en simultaneo permitió la construcción de las curvas de correlación (TD vs Log UFC).
Aptitud del método: Clobetasol propionato 0.05%
El Clobetasol propionato 0.05% crema utiliza dentro de su fórmula maestra alcohol bencílico. El modo de acción de los alcoholes se fundamenta en aumentar la permeabilidad de la membrana celular bacteriana, ocasionando lisis microbiana (3). En la aptitud del método se utilizó el Polisorbato 80 0.1% para neutralizar al alcohol bencílico presente en la formulación del Clobetasol propionato 0.05% crema. Esta neutralización funcionó de manera óptima ya que permitió recuperar a C. albicans y A. brasiliensis inoculados durante la aptitud del método (neutralización del preservante) por el método tradicional de conteo en placa y por el método alternativo de Microbiología rápida (% de recuperación ≥ 70%) (ver tabla 1). Esta recuperación de microrganismos en paralelo y en simultaneo permitió la construcción de las curvas de correlación (TD vs Log UFC).
Aptitud del método para materias primas Glicerina USP, Sorbitol 70% no cristalizable y Propilenglicol
Los componentes de las materias primas que puedan dificultar o inhibir el crecimiento de los microorganismos son completamente neutralizado por el Polisorbato 80 (0.1%) adicionado al medio diluyente (Caldo Caseína Soya), obteniendo el cumplimiento del porcentaje de recuperación de los hongos y levaduras desafiados establecido por USP (% de recuperación ≥ 70%) (ver tabla 1). De esta manera, se garantizó la completa recuperación de A. brasiliensis y C. albicans por el MTCP y MMA (Ver tabla 1). Esta recuperación de microrganismos en paralelo y en simultaneo permitió la construcción de las curvas de correlación (TD vs Log UFC).
Continúa leyendo la segunda parte de este interesante estudio en nuestra próxima edición.