La proporción de medicamentos recetados de productos genéricos, como es sabido, está en continuo crecimiento, lo que lleva a un ahorro importante por parte de los pacientes y a un continuo interés por siempre estar en la búsqueda de opciones que puedan contribuir en la reducción de costos en su desarrollo y fabricación.
La Oficina de Calidad Farmacéutica (OPQ) del Centro de Evaluación e Investigación de Medicamentos (CDER) de la FDA publicó recientemente un documento técnico sobre la Madurez en la Gestión de la Calidad (QMM) que es el estado alcanzado cuando los fabricantes de medicamentos cuentan con procesos comerciales consistentes, confiables y sólidos para lograr los objetivos de calidad y promover la mejora continua.
El CDER ha propuesto el desarrollo de un sistema que incentivará a los fabricantes de medicamentos a lograr la QMM en sus plantas. Este sistema podría dar información a reguladores y compradores sobre el desempeño y la robustez de las instalaciones de fabricación de medicamentos y dar a los pacientes una mayor confianza en la disponibilidad de los medicamentos. La puntuación de QMM puede respaldar una mayor flexibilidad para que los fabricantes realicen cambios en la fabricación, posteriores a la aprobación con una menor supervisión.
La puesta en marcha del programa de evaluación de QMM para los fabricantes de productos farmacéuticos requiere de colaboración y transparencia en beneficio de las partes involucradas. La FDA formó un grupo de trabajo para facilitar el desarrollo del programa que está trabajando un marco para calificar objetivamente la QMM de los sitios mediante la integración de evaluaciones interactivas y herramientas digitales con respecto al estado de calidad del sitio. Algunos puntos que vale la pena destacar del Sistema de Calificación de QMM son:
- La FDA se verá beneficiada por este programa ya que estará mejor informada sobre las prácticas de gestión de calidad en los sitios de fabricación, lo que facilitará la toma de decisiones mediante la gestión de riesgos.
- Una evaluación transparente de QMM puede empoderar a los fabricantes para identificar formas de mejorar la eficacia de sus sistemas de calidad, entender las flexibilidades regulatorias descritas en ICH Q12, informar sobre la selección de instalaciones contratadas y obtener ganancias de eficiencia.
- Un sistema de calificación transparente también podría informar a los compradores sobre el alcance de las prácticas de Gestión de la Calidad en los sitios donde compran medicamentos. Sin esta transparencia, existe el riesgo de que el costo sea el factor clave en el mercado sin considerar la inversión de los fabricantes en la calidad de sus productos.
- Los pacientes tendrán un acceso más confiable a los medicamentos cuando la industria tenga un mayor compromiso con la mejora continua. Los procesos de fabricación robustos conducen a menos retiros del mercado y menos escasez por temas de calidad.
El uso efectivo de estas métricas de calidad es clave para lograr un programa robusto de QMM.
El CDER ha mantenido un enfoque en la calidad farmacéutica del siglo XXI, que describe como “un sector de producción flexible, ágil y de máxima eficiencia que produce de manera confiable medicamentos de alta calidad sin una supervisión regulatoria extensiva”1. Para lograr esto se requiere ir más allá del simple cumplimiento de los estándares mínimos de CGMP y acercarse a sistemas de gestión de calidad robustos. La norma CFR 21 parte 210 y 211 y la guía ICH Q7 describen los estándares mínimos de CGMP. El simple cumplimiento de las GMP no indica que la compañía invierte en mejoras para prevenir la falta de suministro. La ICH Q10 mejora los estándares con el concepto de un sistema de calidad farmacéutico eficaz durante el ciclo de vida del producto; describe las actividades de gestión y mejora continua para eficientar los elementos del Sistema de Calidad Farmacéutico (PQS), utilizando los principios de gestión del conocimiento y gestión de riesgos de calidad.
QMM es un estado que se logra al tener un proceso consistente, confiable y robusto para lograr los objetivos de calidad y promover la mejora continua. Para medir el QMM se necesita determinar qué tan minuciosamente un fabricante ha logrado implementar los conceptos ICH Q10.

Los requisitos de CGMP definen los estándares mínimos para comercializar productos farmacéuticos en Estados Unidos. La guía ICH Q10 aumenta el concepto de un sistema de calidad farmacéutico efectivo durante el ciclo de vida de un producto. QMM requiere, en parte, la implementación minuciosa de los conceptos de la ICH Q10 para mejora continua.
Las clasificaciones de transparencia podrían empoderar a los fabricantes para la identificación de formas de mejorar la efectividad de sus PQS, identificar las flexibilidades regulatorias descritas en la ICH Q10 y ayudar a mover la industria farmacéutica hacia 6 Sigma (no más de 3.4 defectos por millón)2.
La FDA evalúa la calidad en la formulación, el proceso y las instalaciones, asimismo monitorea e inspecciona las instalaciones de fabricación para asegurarse de que los riesgos están controlados.
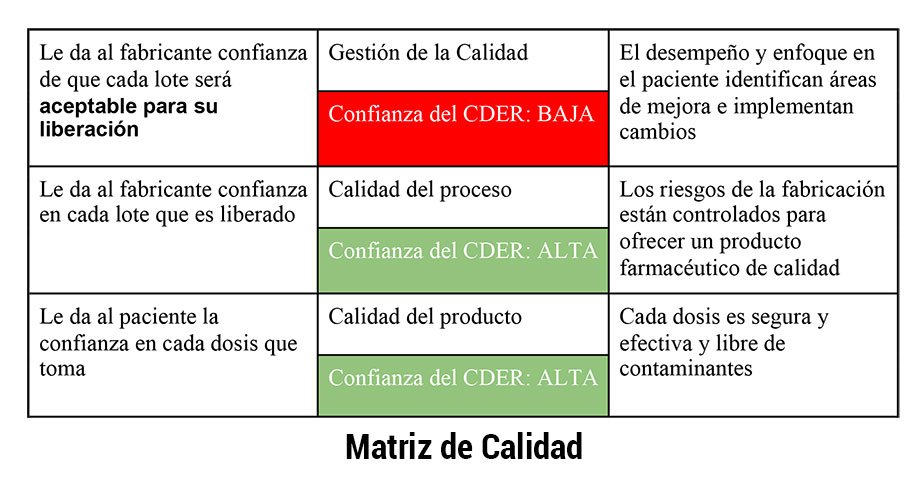
La QMM utiliza un enfoque y desempeño paciente para identificar áreas de mejora e implementar los cambios en consecuencia. Esto dará a los fabricantes la confianza de que cada lote fabricado será aceptado para su liberación. La QMM asegura en el mercado un producto de calidad desde que entra y durante todo el ciclo de vida. La evaluación de QMM no es parte de la evaluación de la FDA; la responsabilidad de la QMM recae únicamente en el fabricante.
La QMM pretende asegurar tener un producto de calidad en el mercado, sin que haya problemas de abastecimiento a causa de la calidad del producto.
Se necesita el compromiso de un trabajo colaborativo entre la industria, academia y todas las partes involucradas para diseñar y poner en marcha un programa de métricas de calidad con el enfoque que se pretende.
Un PQS efectivo utiliza la gestión de riesgos de calidad para gestionar los riesgos de disponibilidad del producto relacionados con los peligros en las operaciones de la compañía farmacéutica y sus socios externos. La integración del diseño de fabricación, la supervisión de los proveedores y la previsión de la demanda puede conducir a la optimización de los niveles de inventario y a la mejora de los niveles de servicio al cliente. Se ha comprobado que un alto grado de QMM tiene un impacto positivo en una organización.
Las principales partes interesadas impactadas por un programa de calificación QMM comprenden las “6 Ps” de la cadena de suministro farmacéutica: fabricantes, compradores, pagadores, farmacias, proveedores y pacientes. Es muy importante la participación de todas estas partes involucradas. Existen tres áreas clave identificadas en las que se requiere colaboración: evaluar las percepciones en torno a la calidad para mejorar la comunicación, mejorar la transparencia y desarrollar calificaciones de calidad.
Se ha encontrado que los compradores a veces reciben información no pública limitada sobre la gestión de calidad de la cadena de suministro (incluidos datos de la capacidad de proceso) de los fabricantes durante el proceso de contratación. Sin embargo, es más probable que se proporcionen estos datos cuando existe competencia de varias fuentes para un producto. El hecho de tener una mejor comprensión de la cadena de suministro puede ayudar a los fabricantes en la toma de decisiones de compra.
La FDA formó un grupo de trabajo multidisciplinario y multicéntrico para facilitar el desarrollo de un programa de calificación de QMM. Este grupo de trabajo desarrolló un marco para asegurar y medir de manera objetiva la QMM de los sitios de producción utilizando un sitio interactivo con vigilancia virtual. En el desarrollo de este marco, la FDA considera herramientas de valoración estandarizadas, enfoques regulatorios, incentivos de la industria, transparencia y comunicación. Conforme el CDER ha empezado a desarrollar el programa de QMM, las partes comprometidas han empezado a identificar los retos clave a superar para lograr que el programa tenga éxito.
Las distintas partes involucradas definen la “calidad farmacéutica” de diferentes formas. Para algunos es la calidad del proceso de fabricación y su capacidad de producir un suministro confiable de medicamentos resiliente a las interrupciones y la escasez de suministros. Otros lo describen como un producto libre de contaminación y defectos que podrían afectar su seguridad y eficacia.
Debe quedar claro que las calificaciones reflejan la QMM en un sitio de fabricación y no la calidad del producto en sí o del proceso utilizado para fabricarlo. Además, las partes deben educarse en lo que implican estas calificaciones.
Los retos para el CDER
- Convencer a los compradores de considerar la QMM para la toma de decisiones. Para explicar la matriz de calidad, se necesita describir la importancia de utilizar las métricas de QMM en las decisiones de compra a las partes involucradas que normalmente no consideran la calidad en la toma de decisiones.
- Separar la evaluación de QMM del cumplimiento normativo. La transparencia, el compromiso y la colaboración son críticas para asegurar que los fabricantes comprendan el programa de QMM y sus implicaciones en la calidad y producción farmacéutica. Las evaluaciones y métricas de QMM deben estar a cargo del CDER, de manera independiente de la determinación del cumplimiento de las normas regulatorias. Cuando se asigna la métrica más baja, implica que el sitio de fabricación al menos cumple con los requisitos regulatorios.
- Necesita apoyarse de los compradores para entender la cadena de suministro. Las métricas basadas en los sitios de manufactura son limitadas cuando los compradores no conocen las instalaciones específicas de los fabricantes del medicamento o componentes de la formulación, especialmente el API. Es posible que la FDA no pueda proporcionar información específica sobre la cadena de suministro del producto farmacéutico y que dependa de los compradores obtenerla durante los procesos de negociación. La mayoría de los compradores solicita información sobre el sitio de fabricación como parte de su proceso en la toma de decisión.
- Necesita que el mercado recompense a los productores con instalaciones con un mayor QMM. Existe preocupación por la influencia de una alta QMM en los costos durante los acuerdos comerciales. Considerar a la QMM en las decisiones de compra debería incentivar la mejora continua a largo plazo, y no sacar a los fabricantes del mercado y/o aumentar los costos de compra a corto plazo. De hecho, puede haber un beneficio de ahorro a largo plazo.
En las organizaciones en las que los objetivos impulsan la calidad, el negocio no está separado de los objetivos de calidad. Aunque la cultura de calidad debe empezar desde arriba, el personal en cada nivel dentro de la organización debe contribuir en este compromiso. Esta forma de trabajo se requiere para lograr niveles altos de QMM.
Una herramienta de evaluación de QMM debe ser objetiva y consistente en todos los sitios de fabricación e independiente del producto o del tamaño de las operaciones. Las evaluaciones de QMM pueden ser realizadas por la FDA o por un tercero autorizado para realizar dichas evaluaciones en los sitios de fabricación.
Se debe validar una herramienta de evaluación de QMM estandarizada. Las calificaciones de QMM deben ser confiables y consistentes entre el personal que realiza las evaluaciones. Pueden usarse otros datos internos o externos para complementar los resultados de la evaluación final como el historial de escasez, inspecciones, métricas de calidad e informes de alerta y reportes de desviación.
Las interrupciones y escasez de suministro tienen un costo que afecta a toda la cadena farmacéutica de suministro.
Entre los incentivos regulatorios para los fabricantes relacionados con la QMM podrían estar reducir la frecuencia de inspecciones, una mayor flexibilidad regulatoria al realizar cambios posteriores a la aprobación y una mejor comprensión de la cadena de suministro. Las cadenas de suministro más robustas y confiables son el resultado que beneficiará desde los fabricantes hasta los pacientes a largo plazo.
La transparencia es crítica para establecer un sistema de mediciones de QMM. Comprender las intenciones del programa, así como el impacto final en la escasez de medicamentos y los resultados de los pacientes es fundamental para convencer a los fabricantes farmacéuticos de que adopten un sistema de calificación de QMM.
El sistema de calificación debe incorporar elementos clave que fomenten una cadena de suministro de medicamentos más sólida y un mayor compromiso con la calidad en la producción farmacéutica en beneficio de todas las partes involucradas. Se podrá contar con más información sobre la robustez de la cadena de suministro y se evitarán problemas de abastecimiento a causa de la calidad.
La FDA podrá estar más informada sobre las prácticas de gestión de la calidad en los sitios permitiendo mejores decisiones en la asignación de recursos (tiempo y frecuencia de inspecciones) y flexibilidad regulatoria (en relación con los cambios posteriores a la aprobación). De esta manera, en lugar de centrarse en los resultados negativos, se estará más cerca de una regulación basada en el desempeño. Se verá facilitado el proceso de regulación de los cambios posteriores a la aprobación. La guía ICH Q12 proporciona un marco que facilita estos cambios de una manera más predecible y eficiente aumentando la transparencia entre la industria y las autoridades regulatorias apoyando la innovación y la mejora continua. Como se mencionó antes, se deben seguir los requerimientos de CGMP, pero se necesita un PQS para utilizar las herramientas descritas en ICH Q12. Claramente, un programa robusto de QMM permitirá implementar de manera más efectiva ICH Q12.
En mayo y junio de este año, se llevó a cabo un taller público sobre el desarrollo del programa de QMM. Como parte del programa del taller se incluyeron temas como: La visión del CDER, Antecedentes y soluciones duraderas de la escasez de medicamentos, Métricas de calidad y cómo se complementan ICH Q12 y QMM, Lecciones aprendidas con los dos ensayos piloto, El impacto de los sistemas de calificación de calidad con base en el aprendizaje de otras industrias, análisis económico y de riesgo de las calificaciones de calidad y el efecto sobre la industria farmacéutica, cómo puede informar este sistema de clasificación a las organizaciones compradoras, así como el aumento de la resiliencia de la cadena de suministro de medicamentos. En el taller participaron universidades, industria local y externa además de la parte regulatoria.
Los dos ensayos pilotos se realizaron con fabricantes farmacéuticos. Uno de ellos se enfocó en fabricantes locales de producto terminado y el otro en fabricantes externos de APIs. La retroalimentación de los participantes en el programa piloto ayuda a determinar cuáles son las mejores prácticas para llevar a cabo las evaluaciones, la herramienta de evaluación y la logística. Minimizar la carga en los sitios de fabricación durante las evaluaciones es una consideración importante para desarrollar un programa de QMM. Haber realizado estos dos ensayos de QMM proporcionó una gran cantidad de información sobre cómo se podría implementar el futuro protocolo de evaluación de QMM destacándose consideraciones adicionales al programa.
Se espera que la transparencia de los fabricantes mejor calificados, les dé una ventaja competitiva permitiéndoles aumentar su participación en el mercado. Los fabricantes con mayor QMM se enfocan en la mejora continua y, por lo tanto, es más probable que adopten tecnologías de fabricación avanzadas que puedan mejorar la capacidad y la robustez de la industria y conducir a una expansión de la producción farmacéutica local. Los beneficios son claros, los fabricantes con mayor QMM obtienen reconocimiento en el mercado; los compradores obtienen más información y, por ende, confianza en la cadena de suministro de los medicamentos o ingredientes de la formulación que compran; pacientes, farmacias y personal de la salud obtienen medicamentos con menor riesgo de desabasto.
Las métricas de QMM son parte de la evolución hacia una práctica regulatoria basada en el desempeño. La transparencia es un motor necesario para la mejora de la industria.
Cabe resaltar la importancia de buscar proveedores que se ocupen de la implementación de sus sistemas de calidad y permitan tener una relación de transparencia y trabajo colaborativo.
Por: QFB Nadia Martínez González












