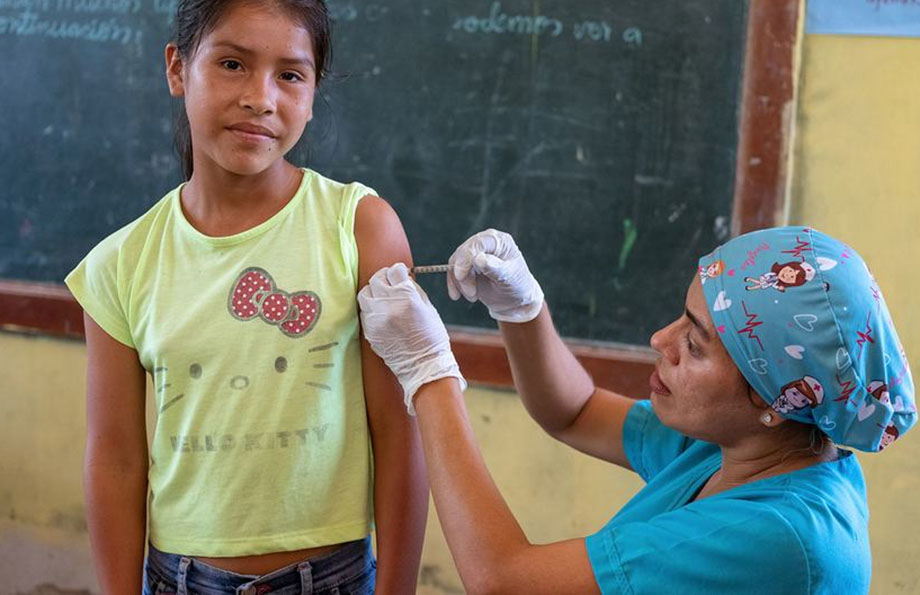
Comunicado. La OMS anunció que agregó la vacuna Cecolin de dosis única a la lista de inmunizaciones contra el papiloma humano. Se trata de la cuarta vacuna contra ese virus.
La vacuna estaba precalificada y los nuevos datos revelaron que cumple con los criterios establecidos por la OMS sobre el uso alternativo no autorizado de las vacunas contra el virus en esquemas de dosis única.
La agencia sanitaria sostuvo que esta vacuna ayudará a aumentar las reservas de inmunizaciones, permitiendo así llegar a más niñas para que estén protegidas del cáncer de cuello uterino. Tedros Adhanom Ghebreyesus, director general de la OMS, afirmó que, a diferencia de la mayoría de los demás tipos de cáncer, existe la capacidad de eliminar el cáncer de cuello uterino,” junto con sus dolorosas desigualdades”.
Y agregó: “Al agregar otra opción para un esquema de vacunación de una dosis contra el virus del papiloma humano, hemos dado un paso más para relegar el cáncer de cuello uterino a la historia”.
Ese virus causa más del 95% de los 660 mil casos de cáncer de cuello uterino que ocurren en el mundo cada año. La OMS destacó que cada dos minutos muere una mujer a causa de esta enfermedad prevenible. El 90% de estas muertes se producen en países de renta baja y media. De los 20 países más afectados por el cáncer de cuello uterino, 19 están en África.
La vacuna contra el papiloma humano existe desde 2018 pero la escasez de suministro mundial dificultó su distribución. Además, uno de los fabricantes tuvo problemas de producción este año, provocando un déficit que podría afectar a millones de niñas en África y Asia. La estrategia de la OMS para la eliminación del cáncer de cuello uterino tiene como primer objetivo vacunar contra el papiloma humano al 90% de las niñas antes de que cumplan 15 años.
“Dados los continuos desafíos de suministro, esta incorporación de la vacuna de dosis única significa que los países tendrán una mayor variedad de vacunas para llegar a más niñas”, apuntó Kate O'Brien, directora del Departamento de Inmunización y Vacunas de la OMS.
Un número cada vez mayor de productos vacunales que inicialmente estaban precalificados para su uso en un esquema de dos dosis ahora pueden utilizarse en un esquema de dosis única. En 2023, 37 países administraron el esquema de dosis única. Para el 10 de septiembre de 2024, eran 57 los países que lo hacían. La OMS estima que este incremento resultó en que por lo menos seis millones adicionales de niñas recibieran la vacuna contra el papiloma el año pasado.
Hoy también publicamos las siguientes notas y más...
Anuncian nombramientos respecto a la Secretaría de Salud de México
Kedrion y Biotest acuerdan distribución para tratamiento de plasma sanguíneo en Estados Unidos