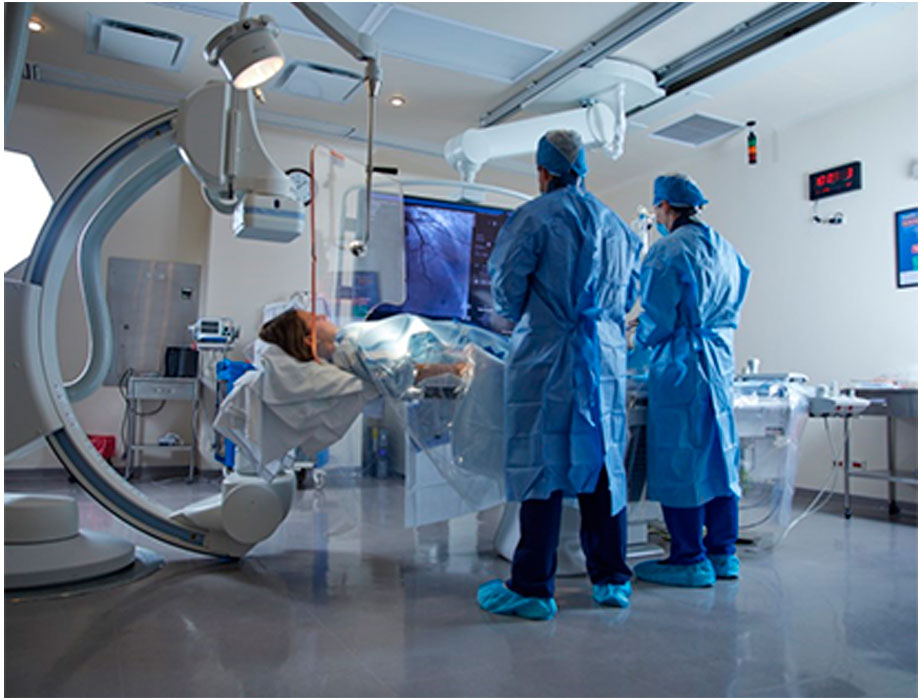
Comunicado. La inteligencia artificial (IA) se posiciona como una herramienta en la detección, clasificación y tratamiento de enfermedades cardíacas de acuerdo con especialistas de TecSalud. Ésta ofrece tecnologías valiosas y conocimientos clínicos que mejoran la atención médica y permiten identificar de manera temprana problemas cardíacos en conjunto con equipos multidisciplinarios de médicos.
En México, las enfermedades del corazón representan la principal causa de muerte, con 189,289 defunciones en 2023, de este total, 100,473 fueron hombres y 88,802 mujeres de acuerdo con las Estadísticas de Defunciones Registradas (EDR) recopiladas por el INEGI.
Las enfermedades cardiovasculares son trastornos que afectan tanto al corazón como a los vasos sanguíneos, comprometiendo el funcionamiento adecuado del sistema circulatorio. Entre ellas se encuentran la insuficiencia cardiaca, arritmias y otros problemas que pueden reducir la capacidad del corazón para bombear sangre de manera eficiente.
De acuerdo con Erasmo de la Peña Almaguer, director del Instituto de Cardiología y Medicina Vascular del Hospital Zambrano Hellion de TecSalud, la IA se ha convertido en un apoyo en el diagnóstico y tratamiento de enfermedades cardíacas ya que ayuda a mejorar las decisiones médicas, al ser una herramienta que ayuda al médico y al paciente a determinar cuándo es necesario realizar una cirugía o una intervención en pacientes con obstrucciones en las válvulas cardíacas o en las arterias coronarias.
“En este Día Mundial del Corazón hacemos un llamado a la población a cuidar su salud cardiovascular ya estar atentos a los avances tecnológicos que pueden marcar la diferencia, por ejemplo, en el área de imagenología de TecSalud, el uso de inteligencia artificial nos ha permitido predecir de manera no invasiva quién necesitará de la apertura de una arteria y quién no, utilizando dinámicas de fluidos computacionales, desde la detección muy temprana de depósitos de colesterol en las arterias y análisis de los tejidos cardíacos de manera no invasiva y sistemas basados ‘Machine Learning’ usando Big Data, lo que nos brinda un análisis más preciso”, explicó De la Peña Almaguer.
Los estudios de imagen permiten detectar de manera temprana el endurecimiento de las arterias en pacientes, lo que puede derivar en obstrucciones causadas por factores como el tabaquismo, la diabetes o el colesterol elevado; este riesgo es más común en hombres mayores de 50 años, quienes presentan una mayor probabilidad de desarrollar estas complicaciones.
En el ámbito de la cardiología preventiva, es importante que los pacientes conozcan sus indicadores de salud: presión arterial, niveles de glucosa e insulina, y el colesterol de lipoproteínas de baja densidad (LDL). Estos parámetros evalúan el riesgo cardiovascular. Además, cuando sea posible, se recomienda medir la presencia o ausencia de calcio en las arterias coronarias mediante tomografía, lo que permite identificar muchos años antes de un evento, la presencia de un riesgo aumentado y tomar preventivas para evitar problemas cardiacos futuros.
Hoy también publicamos las siguientes notas y más...
Novartis publica nuevos datos positivos de su tratamiento para esclerosis múltiple