Comunicado. La OMS publicó una guía para mejorar el diseño, la realización y la supervisión de los ensayos clínicos en países de todos los niveles de ingreso. Esta guía tiene como objetivo apoyar ecosistemas de investigación y desarrollo (I+D) más sólidos y dirigidos por los países para hacer avanzar la ciencia de la salud, de modo que las personas de todo el mundo puedan acceder de manera más rápida y asequible a las intervenciones de salud nuevas, seguras y eficaces.
Por primera vez, la OMS ofrece recomendaciones a las autoridades de salud nacionales, las autoridades reguladoras, los organismos de financiación y otros interesados sobre la mejor manera de facilitar los ensayos clínicos para generar evidencia sobre las intervenciones de salud. Aborda desafíos como el diseño deficiente de los ensayos, la escasa diversidad de participantes, la insuficiencia de infraestructuras y los obstáculos burocráticos, que cuestan tiempo, dinero y vidas.
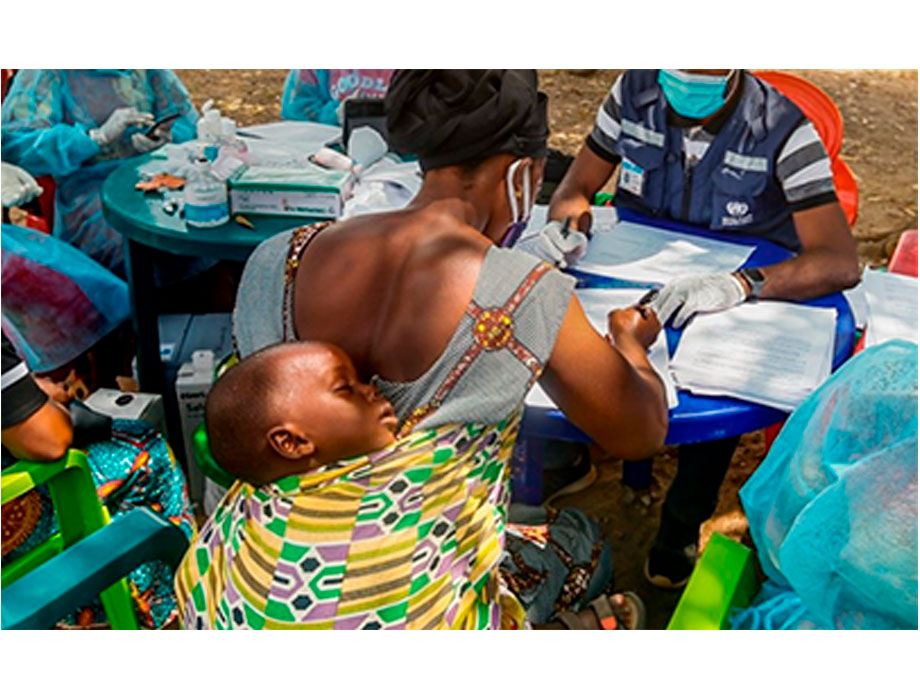
Las brechas mundiales entre los países de ingreso alto y los de ingreso bajo y mediano están provocando graves inequidades en los ensayos clínicos. En 2022 hubo 27,133 ensayos en los 86 países de ingreso alto del mundo, en comparación con 24,791 en 131 países de ingreso bajo y mediano. En ocasiones, los países de ingreso bajo y mediano han sido incluidos en ensayos clínicos debido a su carga de enfermedades; sin embargo, los datos obtenidos se han utilizado únicamente para autorizar intervenciones de salud en los países de ingreso alto, pero no en los países de ingreso bajo y mediano.
“El fortalecimiento de la investigación y el desarrollo dirigidos por los países y la incorporación de los ensayos clínicos a los servicios clínicos y de salud pública habituales garantizarán un acceso más rápido y equitativo a intervenciones seguras y eficaces, lo que ayudará a las personas a estar más sanas. Esta nueva guía tiene como objetivo mejorar la diversidad de los participantes en los ensayos para garantizar que la investigación beneficie a la gama más amplia posible de personas y se aleje de manera decisiva de un enfoque único”, dijo Jeremy Farrar, director científico de la OMS.
Según datos de 2022, menos del 5% de los ensayos clínicos incluyeron a mujeres embarazadas, y sólo el 13% incluyeron a niños. Esto ha disminuido la calidad de la evidencia, lo que afecta a la atención y al acceso a las intervenciones. La ausencia de pruebas adecuadas en las poblaciones infrarrepresentadas puede conducir a un enfoque cauteloso a la hora de tratarlas, lo que repercute negativamente en su salud. Además, esta brecha en la representación también puede hacer que las personas de estos grupos estén menos dispuestas a aceptar las recomendaciones de salud.
Hoy también publicamos las siguientes notas y más...
Boehringer Ingelheim amplía investigación sobre cáncer en su sede de Viena