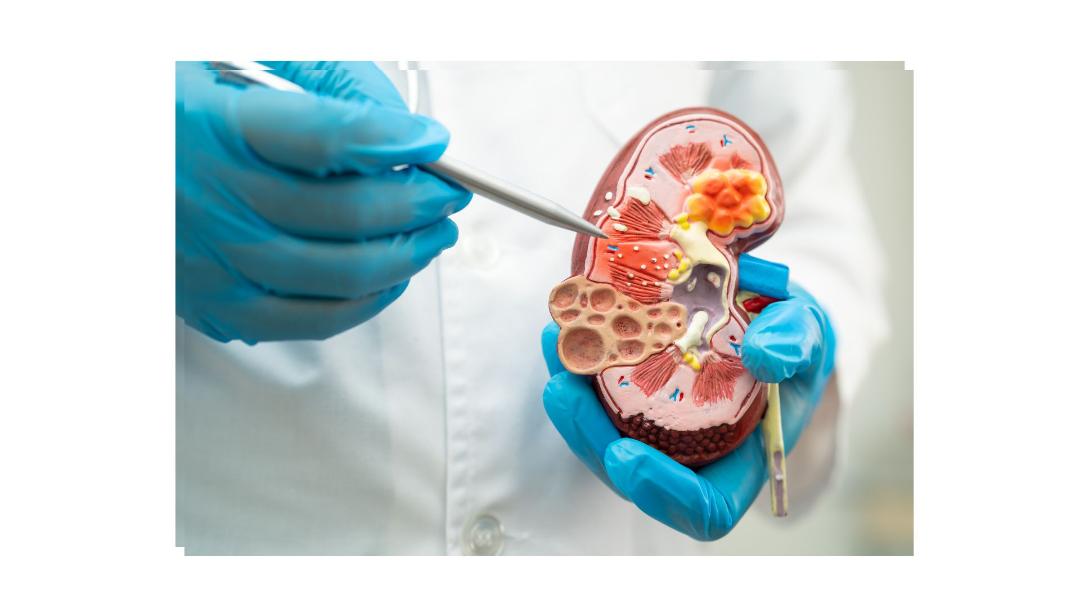
Comunicado. Rectify Pharmaceuticals, empresa de biotecnología pionera en moduladores funcionales positivos (PFM) que restauran y mejoran la función de las proteínas de membrana, firmó un acuerdo estratégico de investigación y licencia con Boehringer Ingelheim para acelerar el desarrollo de tratamientos para la enfermedad renal crónica (CKD) y otras afecciones.
La colaboración aprovecha la plataforma PFM de Rectify para desarrollar pequeñas moléculas orales que mejoran la función de la proteína ABCC6 y reducen la calcificación, un factor clave en la disfunción cardiorrenal en las enfermedades renales crónicas. Según los términos del acuerdo, Rectify recibirá un pago por adelantado y tiene el potencial de obtener hasta 448 mdd a través de hitos preclínicos, clínicos, regulatorios y comerciales, además de regalías escalonadas sobre las futuras ventas del producto.
“La colaboración de Rectify con Boehringer Ingelheim valida el potencial de nuestra plataforma PFM para mejorar la función de las proteínas de tipo salvaje y abordar la biología de la enfermedad subyacente, abriendo la puerta a grandes oportunidades en enfermedades comunes como la enfermedad renal crónica (ERC), que afecta a millones de personas. Nos complace colaborar con Boehringer Ingelheim, quienes comparten nuestro compromiso de abordar las necesidades no cubiertas en enfermedades graves con opciones de tratamiento limitadas. Nuestra colaboración representa un importante paso adelante para que Rectify impulse el desarrollo de nuevas terapias modificadoras de la enfermedad que podrían cambiar radicalmente los resultados de los pacientes”, afirmó Rajesh Devraj, director ejecutivo y presidente de Rectify.
La plataforma PFM de Rectify ofrece un enfoque diferenciado para el desarrollo de tratamientos modificadores de la enfermedad que se dirigen a los factores fundamentales de la disfunción cardiorrenal. La capacidad de mejorar la función de ABCC6 y reducir la calcificación abre nuevas posibilidades para los pacientes con ERC y otras enfermedades donde la calcificación es una patología clave. Nos entusiasma colaborar con los científicos de Rectify para ofrecer nuevos tratamientos muy necesarios a las personas que viven con ERC y otras enfermedades, afirmó Søren Tullin, Director Global de Investigación de Enfermedades Cardiovasculares, Renales y Metabólicas de Boehringer Ingelheim.
Hoy también publicamos las siguientes notas y más...
Sonora y el Norte de México encabezan consumo de medicamentos sin receta
China anuncia que bajará en 2026 los aranceles de importación de ciertos productos sanitarios