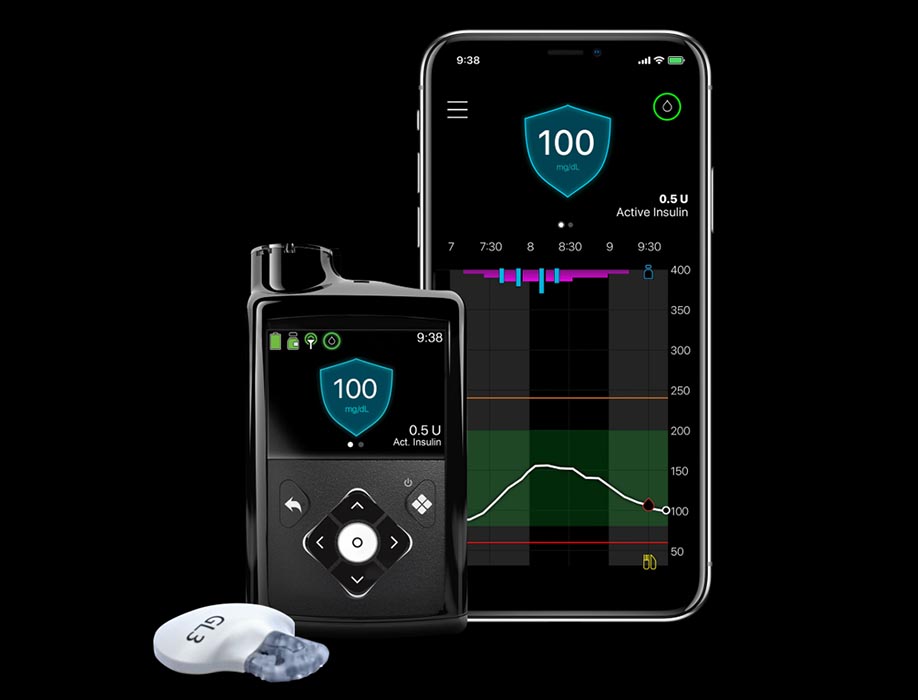
Comunicado. Medtronic presentó evidencia clínica y resultados reales de usuarios en México del Sistema MiniMed 780G, una tecnología que automatiza la administración de insulina y ha mostrado un impacto positivo en el tratamiento de la diabetes tipo 1.
Este sistema incorpora un sensor de glucosa, una bomba de insulina y un algoritmo inteligente que ajusta automáticamente la administración de insulina. Esta automatización permite mantener los niveles de glucosa en el rango recomendado, reducir la necesidad de intervenciones manuales y brindar mayor estabilidad a lo largo del día. Además, su tecnología SmartGuard ayuda a anticipar episodios de subidas o bajadas de glucosa, lo que mejora la seguridad y disminuye la carga diaria del tratamiento.
En México, la experiencia con la tecnología ha sido muy favorable. En una muestra de 247 usuarios; 128 mujeres y 119 hombres, se observó que, en promedio, permanecen el 90% del tiempo en modo automatizado. En promedio nacional, las personas pasaron el 75% del día con niveles de glucosa dentro del rango saludable, y más del 70% logró estar por encima del objetivo recomendado por los especialistas. Además, el promedio de glucosa fue de 149 mg/dl y el índice de manejo de glucosa (GMI) se mantuvo en 6.8%, dentro de los parámetros ideales.
“Estos resultados demuestran cómo la tecnología está marcando una diferencia real en la vida de quienes viven con diabetes tipo 1. Logramos ver cómo niñas, niños, adolescentes y adultos han podido estabilizar mejor sus niveles de glucosa, descansar mejor, reducir el estrés diario y vivir con mayor libertad”, señaló Nadia Montes, especialista senior en Educación y Entrenamiento de Medtronic para México y Latinoamérica.
En paralelo, se compartieron también hallazgos del análisis de datos en América Latina, los resultados muestran que, con configuraciones óptimas, se logró un promedio regional de 80.1% en tiempo en rango, superando incluso el promedio mundial en condiciones similares. Estos hallazgos refuerzan la consistencia de los beneficios del sistema en distintos perfiles de edad, género y contexto geográfico.
A lo largo del tiempo, el compromiso de Medtronic en México ha ido más allá de la entrega del dispositivo. La compañía ha construido una comunidad de acompañamiento para usuarios, médicos y cuidadores, enfocada en educación continua, capacitación técnica, seguimiento personalizado y actualización constante, todo a través de diferentes modalidades: en tiempo real, a demanda y a distancia, adaptándose a las necesidades de cada persona. Estas acciones han impactado personas usuarias, familiares y cuidadores, así como a más de 150 profesionales de la salud en el país, a través de sesiones uno a uno, grupales y a demanda.
Este enfoque integral ha sido clave para maximizar los beneficios de la tecnología y garantizar su correcta adopción y uso. Medtronic reitera su compromiso de continuar fortaleciendo esta comunidad y expandiendo el acceso a soluciones innovadoras que mejoren la atención médica y la calidad de vida de las personas que viven con diabetes tipo 1 en México.
Hoy también publicamos las siguientes notas y más...
México creará Ecosistema de Biofarma para ser un sitio de producción de medicamentos