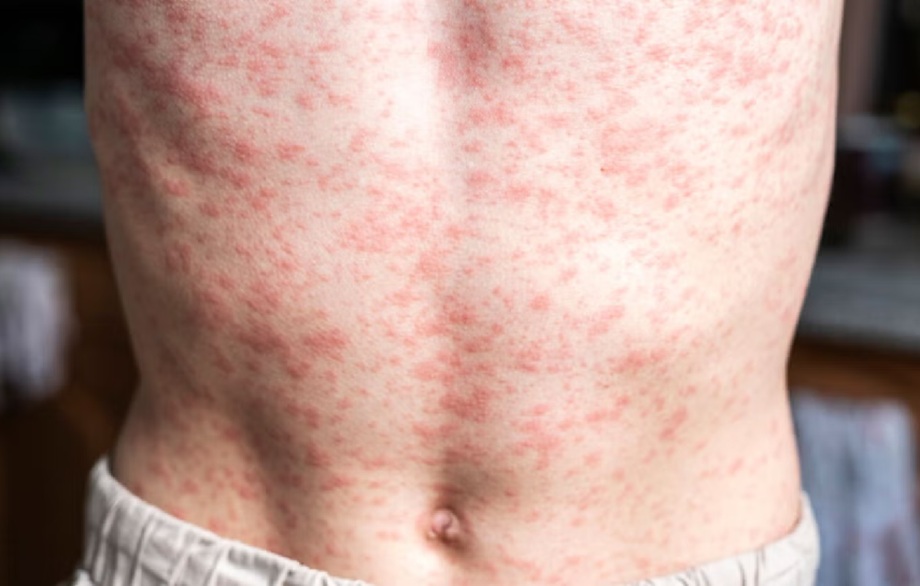
Comunicado. La OPS anunció que el continente americano perdió su estatus como región libre de transmisión endémica del sarampión. La decisión se tomó tras la reunión de la Comisión Regional de Monitoreo y Reverificación de la Eliminación del Sarampión, la Rubéola y el Síndrome de Rubéola Congénita (RVC) de la OPS, realizada en Ciudad de México del 04 al 07 de noviembre de 2025, con el fin de evaluar la situación epidemiológica en la región.
Jarbas Barbosa, director de la OPS, recibió y estuvo de acuerdo con el reporte de la Ccomisión que indica que la transmisión endémica del sarampión se ha restablecido en Canadá, donde el virus ha circulado durante al menos 12 meses. Como resultado, las Américas, que fue la primera región del mundo en eliminar el sarampión en dos ocasiones, ha perdido nuevamente su estatus de libre de sarampión. Todos los demás países de la región siguen manteniendo su estatus.
“Esta pérdida representa un retroceso, pero también es reversible. Mientras el sarampión no se elimine a nivel mundial, nuestra región seguirá enfrentando el riesgo de reintroducción y propagación del virus entre las poblaciones no vacunadas o con vacunación incompleta. Sin embargo, como ya lo demostramos anteriormente, con compromiso político, cooperación regional y una vacunación sostenida, la región puede interrumpir nuevamente la transmisión y recuperar este logro colectivo”, añadió.
Al 07 de noviembre de 2025, se han notificado 12,596 casos confirmados de sarampión en diez países (aproximadamente el 95% de los casos de la región se concentran en Canadá, México y Estados Unidos), lo que supone un aumento de 30 veces en comparación con 2024. Además, se han registrado 28 defunciones: 23 en México, tres en Estados Unidos y dos en Canadá.
En Canadá, México, Estados Unidos, Bolivia, Brasil, Paraguay y Belice persisten brotes activos, la mayoría asociados a casos importados. La transmisión ha afectado principalmente a comunidades con baja cobertura de vacunación; el 89% de los casos corresponde a personas no vacunadas o con estado vacunal desconocido. Los niños menores de 1 año son el grupo más afectado, seguidos por los de uno a cuatro años.
El brote de sarampión en Canadá comenzó en octubre de 2024 en la provincia de New Brunswick y desde entonces se ha extendido por todo el país, con más de 5,000 casos confirmados. Aunque están disminuyendo, la transmisión continúa en Alberta, Columbia Británica, Manitoba y Saskatchewan.
La vacunación sigue siendo la medida más eficaz de protección. En los últimos 25 años, la vacuna contra el sarampión ha evitado más de seis millones de muertes en el continente americano, y se estima que ha prevenido alrededor de 15 millones de muertes en los últimos 50 años.
Hoy también publicamos las siguientes notas y más...
Se aprueba en Europa el uso de Teizeild de Sanofi para pacientes con diabetes