Comunicado. La hernia es una condición médica frecuente que afecta a entre el 10% y el 15% de la población mundial. En México, más del 10% de la población presenta o presentará algún tipo de hernia de pared abdominal durante su vida. De ellas, las hernias inguinales, que se presentan cuando una parte del intestino o grasa abdominal sobresale a través de un punto débil del abdomen o en la zona de la ingle, son las más comunes, ya que representan el 58.5% de todos los casos.
A pesar de su alta prevalencia, muchas personas normalizan los síntomas o postergan su atención, lo que puede comprometer seriamente su calidad de vida. Solo un pequeño porcentaje de personas con hernias busca reparación quirúrgica, en muchos casos porque desconocen sus opciones de tratamiento.
A nivel global se realizan más de 20 millones de reparaciones de hernia inguinal anualmente. Por su parte, en México, los hospitales del sistema público reportan miles de cirugías anuales por esta causa. Por citar un ejemplo, el Anuario Estadístico del Hospital General de México documenta más de 4,000 egresos anuales relacionados con hernias inguinales.
En el marco del Día Mundial de la Hernia, que se conmemora cada 18 de marzo, especialistas hacen un llamado a no ignorar señales como dolor, molestia o abultamientos en el abdomen o la ingle. "Ante cualquier dolor persistente, sensación de presión o abultamiento, es fundamental acudir con un cirujano general certificado, quien es el profesional de la salud indicado para realizar el diagnóstico y definir el tratamiento adecuado", señaló Ricardo Reynoso, cirujano general especialista de la clínica HerniaCare.
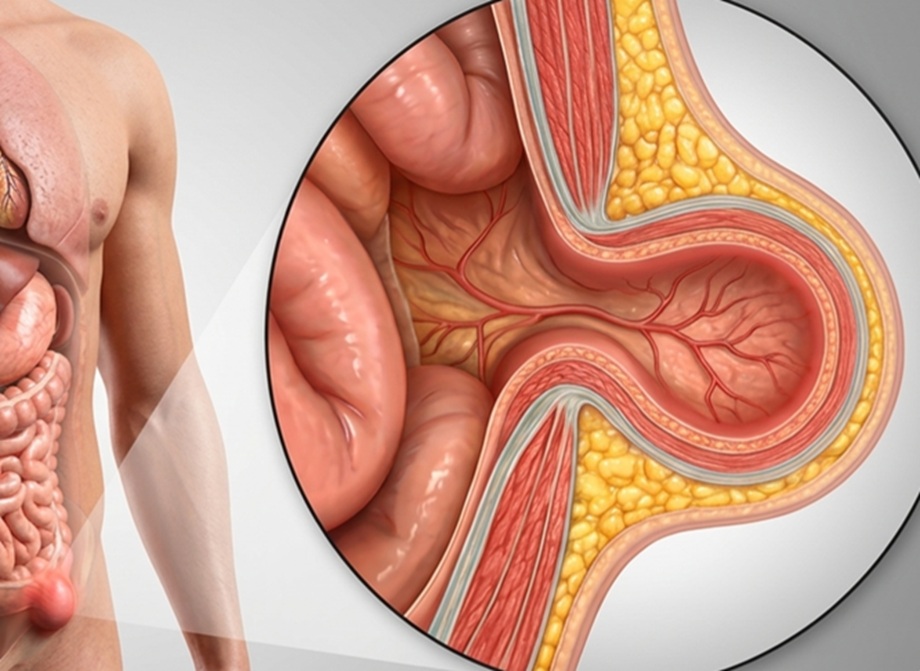
Una hernia es una debilidad o desgarro en la pared muscular abdominal que permite que el revestimiento interno del abdomen y los órganos internos sobresalgan, formando una protuberancia visible. Esta condición se asocia frecuentemente con levantar objetos pesados. Sin embargo, no se producen únicamente por cargar peso, sino por una debilidad de la pared abdominal que puede existir desde el nacimiento o desarrollarse con los años, así como realizar actividades que aumentan la presión abdominal, estreñimiento crónico, sobrepeso u obesidad, y tos crónica.
El signo más característico es un abultamiento bajo la piel del abdomen o la ingle, acompañado de molestia o dolor al pararse, hacer esfuerzo o levantar objetos pesados. Si no se trata a tiempo, la hernia puede aumentar de tamaño, volverse más sintomática y complicar su tratamiento, además de incrementar el riesgo de complicaciones graves como la incarceración o estrangulación, las cuales requieren cirugía de urgencia y pueden provocar náuseas, vómitos e incapacidad para eliminar gases.
El único tratamiento efectivo para las hernias es la cirugía. Actualmente, el estándar de atención incluye técnicas mínimamente invasivas que ofrecen beneficios claros para los pacientes: menor dolor postoperatorio, estancias hospitalarias más cortas y una recuperación más rápida en comparación con procedimientos abiertos tradicionales.
Durante la cirugía para reparar la hernia, el tejido abultado se reintroduce en el abdomen y la pared abdominal se fortalece mediante suturas, frecuentemente, con el uso de mallas biocompatibles. Las técnicas laparoscópicas se realizan a través de pequeñas incisiones, lo que reduce el riesgo de infecciones de sitio quirúrgico, deja cicatrices mínimas, disminuye la estancia hospitalaria y permite a los pacientes reincorporarse antes a sus actividades cotidianas más rápidamente.
La reparación laparoscópica es especialmente recomendada para pacientes activos o con hernias bilaterales, ya que minimiza cicatrices y facilita el retorno a las actividades cotidianas. Este tipo de procedimientos requiere experiencia quirúrgica y tecnología adecuada, por lo que es clave elegir clínicas especializadas con equipos capacitados.
Postergar la atención puede aumentar el tamaño de la hernia y el riesgo de complicaciones graves como la incarceración o estrangulación, situaciones que requieren cirugía de urgencia con mayor impacto para el paciente. En muchos casos, los pacientes no buscan atención médica inmediata, lo que incrementa estos riesgos y puede afectar considerablemente su calidad de vida, al generar dolor crónico o limitación funcional.
Factores como la obesidad, el tabaquismo, la edad avanzada, los antecedentes familiares y la mala cicatrización aumentan el riesgo tanto de desarrollar hernias con recurrencia tras la cirugía. Además, las hernias incisionales —un tipo de hernia ventral que se desarrolla tras cirugías abdominales previas— afectan entre el 10% y 15% de los pacientes que han tenido una cirugía abdominal.
“La valoración temprana en hospitales y clínicas especializadas permite opciones de tratamiento más sencillas y efectivas. Escuchar al cuerpo, reconocer las señales de alerta y acudir oportunamente a atención médica con un cirujano general certificado puede marcar la diferencia en la evolución de la condición y en la calidad de vida”, finalizó Reynoso.

Hoy también publicamos las siguientes notas y más...
Eurofarma divulga su Guía de Sostenibilidad 2026
Roche México colabora con instituciones públicas de salud para mejorar la ruta de diagnóstico en el país