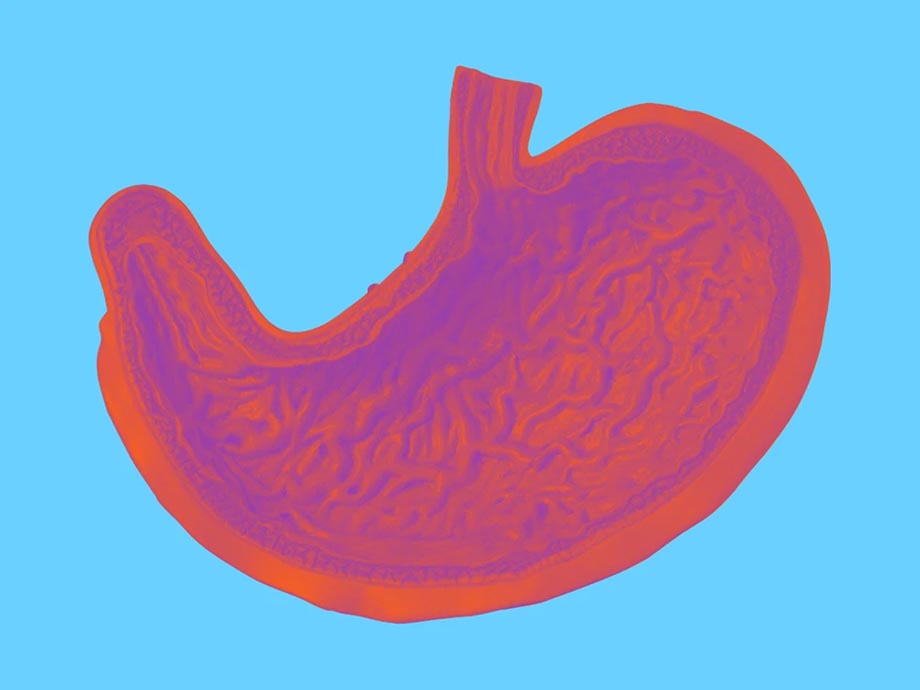
Comunicado. Johnson & Johnson anunció la presentación de una Solicitud de Licencia Biológica Suplementaria (sBLA) ante la FDA para ampliar la aprobación de STELARA (ustekinumab) para el tratamiento de niños de dos años o más con enfermedad de Crohn (EC) activa de moderada a grave.
STELARA está actualmente aprobado para el tratamiento de adultos con EC activa de moderada a grave y colitis ulcerosa, además del tratamiento de adultos y niños de seis años o más con artritis psoriásica activa y psoriasis en placas de moderada a grave.
La sBLA está respaldada por datos del estudio clínico de fase 3 UNITI-Jr, un estudio multicéntrico, abierto para evaluar la eficacia, seguridad y farmacocinética de STELARA para el tratamiento de la EC pediátrica durante 52 semanas.
“Vivir con una enfermedad crónica como la enfermedad de Crohn puede ser increíblemente difícil, especialmente para niños y adolescentes, quienes pueden experimentar síntomas más graves y una progresión más rápida de la enfermedad que los adultos. Con opciones de tratamiento aprobadas limitadas para satisfacer las necesidades específicas de este grupo de pacientes, muchos niños con diagnóstico de enfermedad de Crohn siguen teniendo dificultades. Con el perfil de eficacia y seguridad bien establecido de STELARA en las indicaciones existentes, esta solicitud busca brindar un mejor apoyo a estos pacientes, sus familias y profesionales sanitarios con una nueva opción de tratamiento”, afirmó Chris Gasink, vicepresidente de Asuntos Médicos, Gastroenterología y Autoanticuerpos de Johnson & Johnson Innovative Medicine.
La compañía indicó que del casi millón de personas que viven con EC en Estados Unidos, aproximadamente hasta el 2% son niños, y la tasa de EC en esta población más joven continúa aumentando. La enfermedad de Crohn puede ser más grave en la población pediátrica que en la adulta, lo que resalta aún más la necesidad de opciones de tratamiento adicionales.
Hoy también publicamos las siguientes notas y más...
FDA anuncia a George Tidmarsh como director del Centro de Evaluación e Investigación de Medicamentos