Comunicado. En el marco del Mes de Concientización sobre el Cáncer de la Sangre y el Día Mundial de la Prevención de las Leucemias, que se celebró el pasado 04 de septiembre, Astellas Farma México hizo un llamado a la población para prestar atención a aquellas señales aparentemente inofensivas, como moretones y sangrados frecuentes y sin explicación aparente, que podrían ser indicios de algún tipo de leucemia.
Dentro de los distintos tipos de leucemia que existen, la leucemia mieloide aguda (LMA) es el cáncer de la sangre más común en adultos. En México, tiene una incidencia estimada de 3.5 por cada 100 mil habitantes y es considerado uno de los cánceres más complejos y difíciles de tratar debido a que es poco común, pero muy agresivo, con una tasa de mortalidad de 3.7 por cada 100 mil personas. La LMA se inicia en la médula ósea (la parte blanda del interior de los huesos largos) y pasa a la sangre.
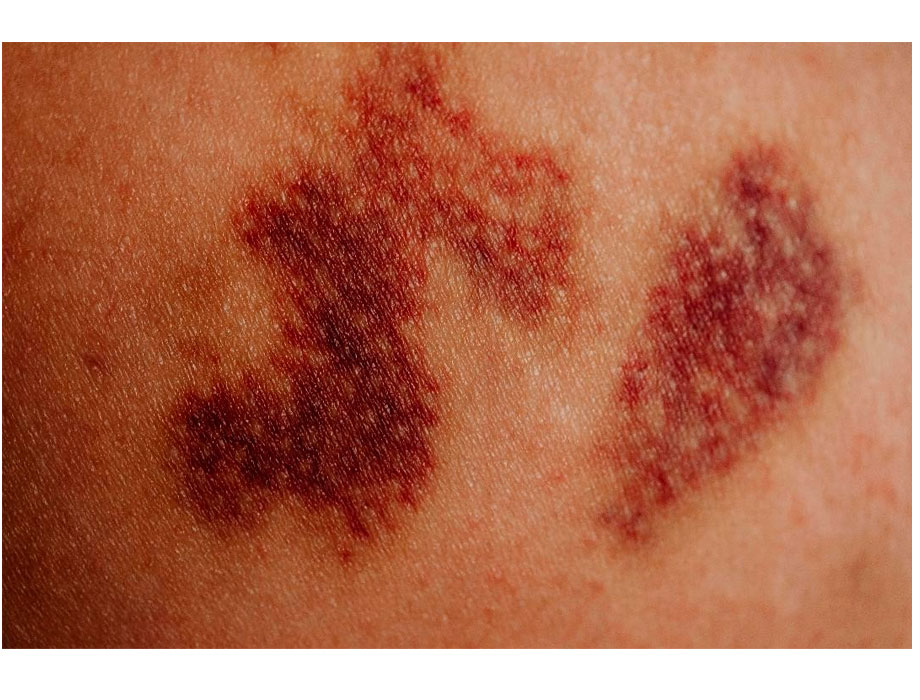
Uno de los mayores desafíos en la lucha contra este y otros tipos de leucemia es su diagnóstico oportuno. A menudo, los síntomas iniciales de esta enfermedad pueden pasar desapercibidos o ser confundidos con dolencias menores. Sin embargo, síntomas como hematomas (moretones) inexplicables, sangrado de las encías y hemorragias nasales frecuentes pueden ser señales tempranas de leucemia. El 24% de las personas con esta enfermedad presentaron estos síntomas en una etapa inicial.
“Los hematomas o moretones se definen como un sangrado que se produce debajo de la piel y que provoca la aparición visible de marcas negras, azules o moradas. La mayoría de las veces no hay motivos para preocuparse por ellos, ya que son la respuesta natural del cuerpo a una lesión. Sin embargo, hay que estar atentos a su extensión, duración y causas”, explicó Sergio Tena, gerente médico de Hematología de Astellas Farma México.
Aunque los hematomas son muy comunes, la manera en la que se forman y su duración son un factor determinante para saber si vale la pena consultar a un médico. Algunas de las señales que podrían indicar que un moretón es síntoma de un trastorno hematológico son: ocurren en lugares inusuales, como espalda, piernas o manos; aparecen muchos a la vez y sin explicación aparente; tardan más de lo habitual en desaparecer y se acompañan de sangrados externos de nariz o encías.
Si bien la leucemia mieloide aguda es un cáncer agresivo, la Sociedad Americana contra el Cáncer ha reportado que 2 de cada 3 pacientes responden al tratamiento, por lo que un diagnóstico temprano es crucial. Por ello, desde Astellas Farma México se promueve información para que cada vez más pacientes sean diagnosticados y así puedan acceder a los tratamientos que requieren para salvar su vida.
Hoy también publicamos las siguientes notas y más...
Ifa Celtis lanza en México una nueva era de Omega-3
Cofepris informa que más de medio millón de trámites finalizaron de manera 100% digital