Comunicado. Gobiernos, donantes, importantes instituciones multilaterales y otras entidades anunciaron y reafirmaron nuevos e importantes compromisos políticos, programáticos y financieros, que incluyen casi 600 mdd en nuevos fondos, para eliminar el cáncer cervicouterino, informó la OPS.
Si las expectativas de ampliar la cobertura de vacunación y fortalecimiento de los programas de tamizaje y tratamiento se cumplen plenamente, el mundo podría eliminar un cáncer por primera vez.
Estos compromisos se asumieron en el primer Foro Mundial para la Eliminación del Cáncer Cervicouterino: Avanzando en el Llamamiento a la Acción, en Cartagena de Indias (Colombia), para promover el impulso nacional y mundial para acabar con esta enfermedad prevenible.
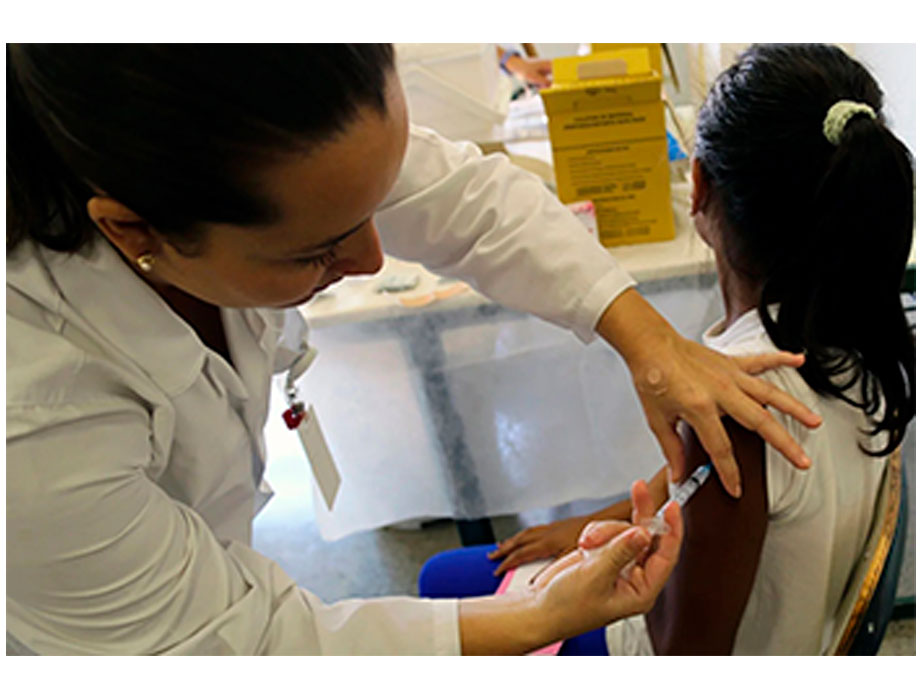
Cada dos minutos, una mujer muere a causa del cáncer cervicouterino, a pesar de que se cuenta con conocimientos y herramientas para prevenir e incluso eliminar esta enfermedad. La vacunación contra el virus del papiloma humano (VPH), la principal causa del cáncer cervicouterino, puede prevenir la inmensa mayoría de los casos y, combinada con el tamizaje y el tratamiento, ofrece una vía para su eliminación.
El cáncer cervicouterino es el cuarto cáncer más frecuente en las mujeres en todo el mundo, y sigue afectando de forma desproporcionada a las mujeres y sus familias en los países de ingresos bajos y medianos (PIBM) en todo el mundo. En un giro importante, la recomendación de la Organización Mundial de la Salud (OMS) emitida en el 2022 a favor del esquema de una sola dosis de la vacuna contra el VPH redujo significativamente los obstáculos para ampliar los programas de vacunación. Esta fue seguida por una recomendación similar en la Región de las Américas en 2023. La Oficina Regional de la OMS para África acaba de seguir su ejemplo con su propia recomendación para que los países de la Región adopten el esquema de dosis única. Hasta la fecha, 37 países han notificado el cambio o la intención de cambiar al esquema de una sola dosis.
Los compromisos anunciados en el foro marcan un momento decisivo para acelerar los progresos en torno a una promesa hecha en el 2020, cuando 194 países adoptaron la estrategia mundial de la OMS para la eliminación del cáncer cervicouterino.
“Tenemos los conocimientos y las herramientas para que el cáncer cervicouterino pase a la historia, pero los programas de vacunación, tamizaje y tratamiento aún no alcanzan la escala necesaria. Este primer foro mundial es una importante oportunidad para que los gobiernos y los socios inviertan en la estrategia mundial de eliminación y aborden las desigualdades que niegan a las mujeres y las niñas el acceso a las herramientas que necesitan para salvar sus vidas”, dijo Tedros Adhanom Ghebreyesus, director general de la OMS.
Hoy también publicamos las siguientes notas y más...
Gilead y Merus descubrirán nuevos activadores de células T triespecíficos basados en anticuerpos
Novavax informa sus resultados financieros del año completo 2023