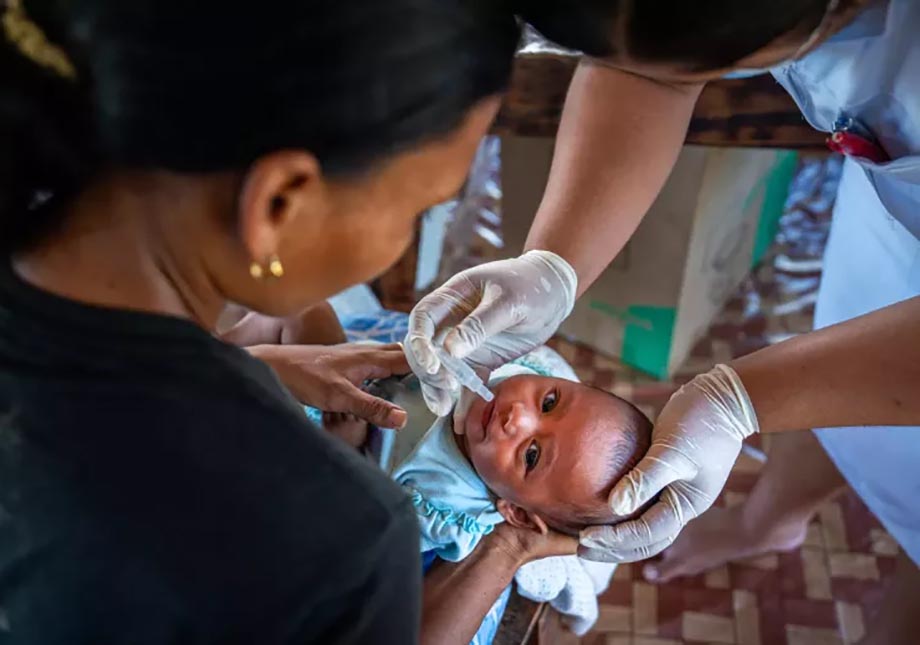
Comunicado. La desinformación, el crecimiento demográfico, las crisis humanitarias y los recortes en la financiación hacen peligrar el progreso y ponen en riesgo a millones de niños, adolescentes y adultos, según han advertido la OMS, UNICEF y Gavi durante la Semana Mundial de la Inmunización, que tiene lugar del 24 al 30 de abril.
Los brotes de enfermedades que se pueden prevenir con vacunas, como el sarampión, la meningitis y la fiebre amarilla, están aumentando en todo el mundo, y enfermedades como la difteria, que llevaba tiempo bajo control y prácticamente había desaparecido en muchos países, también podrían reaparecer. Como resultado, los organismos internacionales están reclamando atención política e inversiones urgentes y sostenidas para reforzar los programas de inmunización y proteger los importantes logros que se han conseguido a lo largo de los últimos 50 años en la reducción de la mortalidad infantil.
“Las vacunas han salvado más de 150 millones de vidas en las últimas cinco décadas. Los recortes en la financiación de la salud mundial han puesto en peligro estos avances que tanto ha costado conseguir. Los brotes de enfermedades que se pueden evitar con vacunas están aumentando en todo el mundo y, como resultado, los países se enfrentan al incremento de los costes del tratamiento de las enfermedades y la respuesta a los brotes, y muchas vidas están en peligro. Los países con recursos limitados deben invertir en las intervenciones de mayor repercusión, entre ellas las vacunas”, afirmó Tedros Adhanom Ghebreyesus, director general de la OMS.
La reaparición del sarampión es especialmente peligrosa. El número de casos ha ido aumentando año tras año desde 2021, en paralelo a las reducciones en la cobertura de inmunización que se produjeron durante la pandemia de Covid-19 y que se han ido sucediendo en muchas comunidades desde entonces. Se estima que los casos de sarampión alcanzaron los 10,3 millones en 2023, un aumento de un 20% en comparación con 2022.
Los organismos advierten de que es probable que esta tendencia al alza se mantuviera en 2024 y lo siga haciendo en 2025, ya que los brotes se han intensificado en todo el mundo. En los últimos 12 meses se han registrado casos de sarampión en 138 países, con brotes de gran magnitud e importantes repercusiones en 61 de ellos. Se trata de la cifra más alta observada en un periodo de 12 meses desde 2019.
En 2024 también hubo un repunte importante de los casos de meningitis en África, una tendencia que ha continuado en lo que va de 2025. Sólo en los tres primeros meses de este año se han notificado más de 5,500 casos sospechosos y cerca de 300 muertes en 22 países, frente a aproximadamente 26 mil casos y casi 1,400 muertes en 24 países el año anterior.
Los casos de fiebre amarilla en la región africana también están en aumento: en 2024 se confirmaron 124 casos en 12 países. Esto sucede después de que en la última década se registraran importantes descensos en los casos de fiebre amarilla, gracias a las reservas mundiales de vacunas y la administración de la vacuna contra la enfermedad en los programas de inmunización sistemática. En la región de las Américas se han confirmado varios brotes de fiebre amarilla desde comienzos de este año, con un total de 131 casos en cuatro países.
“La crisis de financiación mundial está socavando gravemente nuestra capacidad para vacunar contra el sarampión a más de 15 millones de niños y niñas vulnerables que viven en países frágiles y afectados por conflictos. Ya se están produciendo interrupciones en los servicios de inmunización, la vigilancia de enfermedades y la respuesta a los brotes en casi 50 países, y los contratiempos que están surgiendo son similares a los que presenciamos durante la pandemia de COVID-19. No nos podemos permitir perder terreno en la lucha contra las enfermedades que se pueden prevenir”, afirmó Catherine Russell, Directora Ejecutiva de UNICEF.
A pesar de los crecientes desafíos, los esfuerzos conjuntos de la OMS, UNICEF, Gavi y sus aliados han ayudado a los países a ampliar el acceso a las vacunas y fortalecer los sistemas de inmunización a través de la atención de salud primaria. Cada año, las vacunas contra 14 enfermedades salvan cerca de 4.2 millones de vidas, casi la mitad de ellas en la región de África.
Las campañas de vacunación han hecho posible la erradicación de la meningitis A en el cinturón africano de la meningitis. Ahora, una nueva vacuna que protege contra cinco cepas de la enfermedad está ofreciendo resultados prometedores en materia de protección, y se está trabajando para ampliar su uso en las labores de respuesta y prevención de brotes.
Hoy también publicamos las siguientes notas y más...
FDA advierte que medicamento contra la caída del cabello puede causar disfunción eréctil