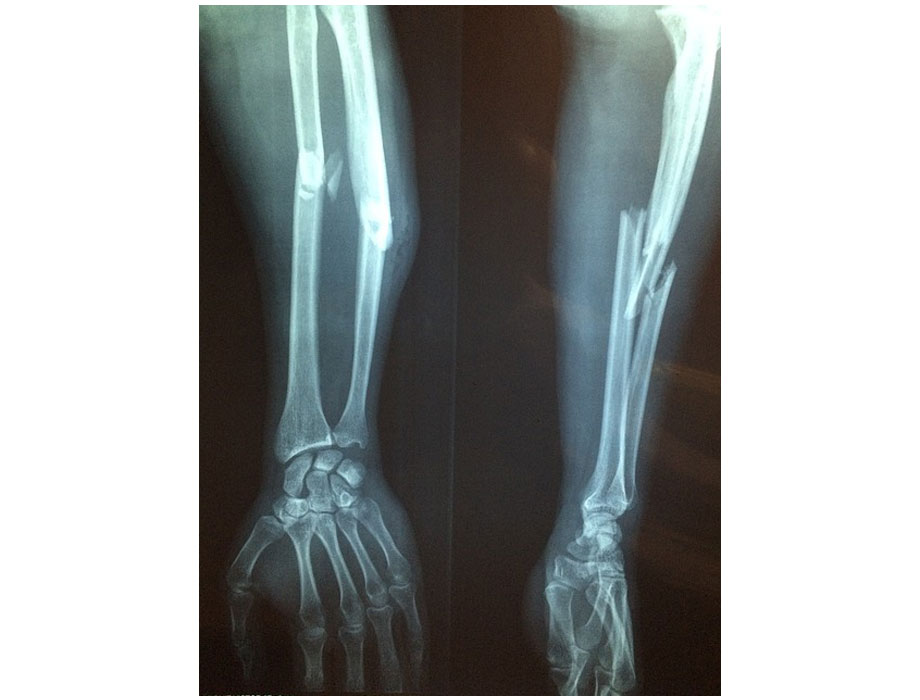
Agencias. Ipsen informó que recibió la aprobación de FDA para su fármaco contra una enfermedad ósea rara. La biofarmacéutica centrada en innovación y atención especializada recibe la aprobación tras la negación de su solicitud por parte de la EMA.
El medicamento está destinado a pacientes adultos y pediátricos desde los ocho años que padezcan fibrodisplasia osificante progresiva (FOP). Palovaroteno se convierte en el primer fármaco en tratar esta enfermedad rara que hasta el momento no tenía ninguna terapia. En todo el mundo alrededor de más de 1,000 personas sufren de esta anomalía rara.
Ipsen obtuvo ya la aprobación en Canadá y en los Emiratos Árabes Unidos. La biofarmacéutica desembolsó 1,000 mdd comprando Clementia Pharmaceuticals para obtener los derechos del palovaroteno en 2019.
Howard Mayer, jefe de investigación y desarrollo de Ipsen, explicó que “por primera vez, los médicos tienen a su disposición un medicamento aprobado que ha demostrado reducir la formación de crecimiento óseo nuevo y anormal, conocido como osificación heterotópica (HO), que causa problemas de movilidad debilitantes y tiene un impacto devastador en la vida de las personas”.
Con esta aprobación, la FDA también emitió a Ipsen un vale de revisión prioritaria de enfermedades pediátricas raras. Este vale se puede usar para solicitudes de medicamentos posteriores que no calificarían para una revisión prioritaria.
Ipsen comercializa más de veinte medicamentos en más de 115 países y cuenta con presencia comercial directa en más de 30 estados. La investigación y desarrollo (I+D) de Ipsen se centra en sus plataformas tecnológicas ubicadas en los principales centros biotecnológicos y ciudades de referencia en ciencias de la vida: París-Saclay (Francia), Oxford (Reino Unido) y Cambridge (Estados Unidos).
Hoy también publicamos las siguientes notas y más...
Contagio de VPH incrementa posibilidad de desarrollar ciertos tipos de cáncer
Johnson & Johnson mantendrá participación del 9.5% en Kenvue