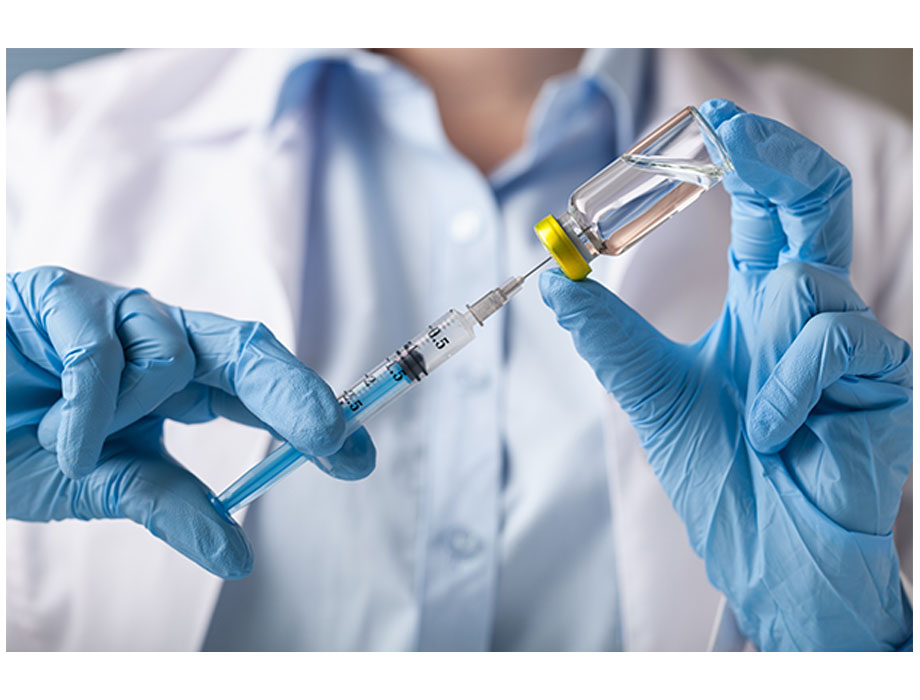
Comunicado. Con base en datos de la OMS, al año se registran cerca de dos millones de accidentes punzocortantes entre trabajadores de la salud, con una tasa de contagio del 37.6% para hepatitis B, 39% para hepatitis C y 4.4% para VIH/SIDA.
Estas infecciones pueden tener graves consecuencias para la salud del trabajador, incluyendo enfermedades crónicas cuyas complicaciones pueden ocasionar la muerte. Además, implican costos asociados para el sistema de salud derivados de pruebas de laboratorio, tratamientos requeridos, profilaxis posterior a la exposición y la ausencia laboral.
“Es fundamental implementar medidas de prevención para reducir el riesgo de punciones accidentales y proteger la salud del personal sanitario mediante el fortalecimiento de las mejores prácticas, el apego a los lineamientos de la Organización Mundial de la Salud en seguridad hospitalaria”, dijo Roxana Trejo, expresidenta de la Asociación Mexicana para el Estudio de las Infecciones Nosocomiales (AMEIN), socia fundadora de la Asociación Latinoamericana de Control de Infección (ASLACI) y gerente de Epidemiología y Control de Infecciones del Centro Médico ABC.
Durante su participación en la mesa redonda "Más seguridad, menos riesgos" llevada a cabo en la "3ª Cumbre Latinoamericana de Terapia Intravascular 2024" en la Ciudad de México, Trejo resaltó la importancia de utilizar dispositivos de seguridad como agujas con capuchón retráctil, agujas especiales para preparación de medicamentos y contenedores para agujas cortopunzantes; así como de brindar capacitación al personal en técnicas seguras de manipulación y eliminación de agujas, e implementar protocolos de seguimiento en caso de sufrir una punción accidental.
Las áreas donde suelen ocurrir estos eventos son los servicios de urgencias, terapia intensiva y/o quirófanos por tratarse de áreas críticas. “Es común que la falta de conciencia lleve a realizar procedimientos como el reencapuchar objetos punzocortantes y/o a la eliminación incorrecta de los mismos. Por ello la necesidad de insistir a través de programas de educación continua sobre todas las estrategias de prevención, como el no reencapuchar las agujas, tampoco doblarlas o romperlas manualmente”, explicó Martha Huertas, expresidenta de AMEIN y actualmente subdirectora de Enfermería Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (INCMNSZ).
A este respecto, un estudio mexicano con seguimiento de 11 años realizado a personal de salud demostró que el de enfermería es el más afectado por los accidentes punzocortantes, con 39% de los casos; 34% eran médicos residentes; 72% de las lesiones estaban relacionadas con agujas. 54.5% de los accidentes ocurrieron en el turno matutino y 23.1% en el nocturno.
Por su parte, María de Lourdes Meléndez, gerente de Medical Affairs en BD, destacó que actualmente existen agujas para preparación y administración de medicamentos que integran funciones de seguridad que ayudan a prevenir punciones accidentales en el personal de salud. “Las agujas con mecanismos de seguridad son aliadas indispensables para el personal de enfermería en su práctica diaria. Su ensamblaje en la jeringa es sencillo, su manipulación durante la inyección es natural y la activación del mecanismo de seguridad tras su uso es muy simple”.
Hoy también publicamos las siguientes notas y más...
Boehringer Ingelheim y Sino Biopharm inician colaboración estratégica en China
Cofepris potencia investigación médica con 20 ensayos clínicos