Comunicado. En el mundo hay mil millones de personas con algún grado de deterioro visual que no ha sido tratado o que pudo haberse evitado con un diagnóstico oportuno y tratamiento adecuado. En México se calcula que hay dos millones 237 mil individuos con deficiencia visual, cifra que se explica porque, quienes se dedican a la optometría en el país, enfrentan diversos obstáculos para realizar su trabajo de forma completa.
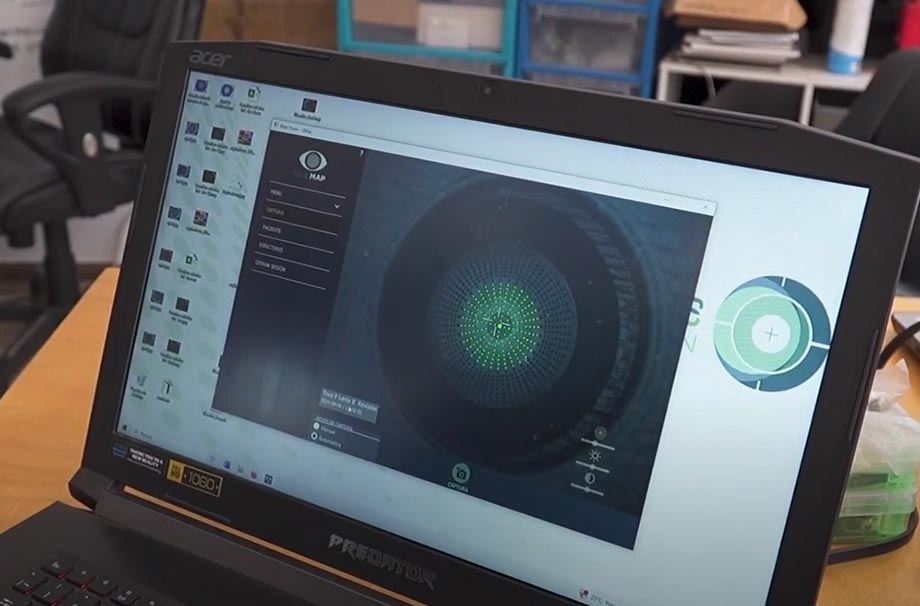
A fin de modificar este escenario, la empresa Bleps Vision –incubada en InnovaUNAM e integrada por especialistas de múltiples disciplinas– creó TOCO, un novedoso topógrafo corneal portátil que mide la superficie anterior de la córnea y detecta problemas de tipo refractivo, como las ectasias corneales (deformación producida por diversas enfermedades).
“También buscamos identificar el queratocono (afección que cambia la estructura de esférica a cónica) o facilitar la adaptación de lentes de contacto”, explica José Rufino Díaz Uribe, socio cofundador y responsable técnico de Bleps Vision.
A decir de la OMS, entre las principales causas de discapacidad visual están los errores de refracción, algo que este dispositivo ayuda a diagnosticar. “La salud visual en el país requiere protección social, campañas y atención permanente, algo en lo que aún hay carencias. Surgimos como una iniciativa que reúne talento capacitado para un desarrollo de alta tecnología”, añade Héctor López Aguado Aguilar, director del emprendimiento y académico en el Centro de Investigaciones de Diseño Industrial de la UNAM.
TOCO, el desarrollo más importante de Bleps Vision, es una herramienta con la que se busca llenar un hueco de instrumentación que afecta a los especialistas en optometría de México.
“Como les es difícil disponer de un área para la medición de córneas (los aparatos para este fin son grandes y demandan condiciones muy específicas) mandan a su paciente con el oftalmólogo para hacerse exámenes. Esto los hace muy dependientes de dichos análisis, además de que en ese ir y venir los resultados llegan a variar. Con TOCO es posible medir en el momento”, señala López Aguado.
El costo, tamaño y portabilidad de este nuevo dispositivo permite transportarlo en un maletín a consultorios, clínicas e, incluso, al lugar donde se encuentre quien necesita una consulta.
“Pensamos en individuos que no pueden cooperar: bebés, niños y personas con problemas de movilidad que no se mantienen erguidas o sentadas. El instrumento va al paciente y no viceversa. Es útil para brigadas de salud, pues se lleva con facilidad a zonas de difícil acceso, como espacios rurales donde no hay infraestructura suficiente para las técnicas o aparatos tradicionales”, expone Rufino Díaz.
Dos aspectos a destacar del producto son su tecnología, que brinda información más rigurosa que otros, y su software, desarrollado específicamente para el dispositivo y que arroja datos seguros al instante. Los topógrafos tradicionales trabajan con un disco de plácido (conjunto de anillos negros y blancos en los que se refleja la córnea y se examina su curvatura). Sin embargo, se ha documentado que dicha técnica presenta un problema de medición llamado rayo oblicuo, que propicia errores en los resultados.
Hoy también publicamos las siguientes notas y más...
OMS advierte que la tuberculosis vuelve a ser la principal causa infecciosa de muerte en el mundo
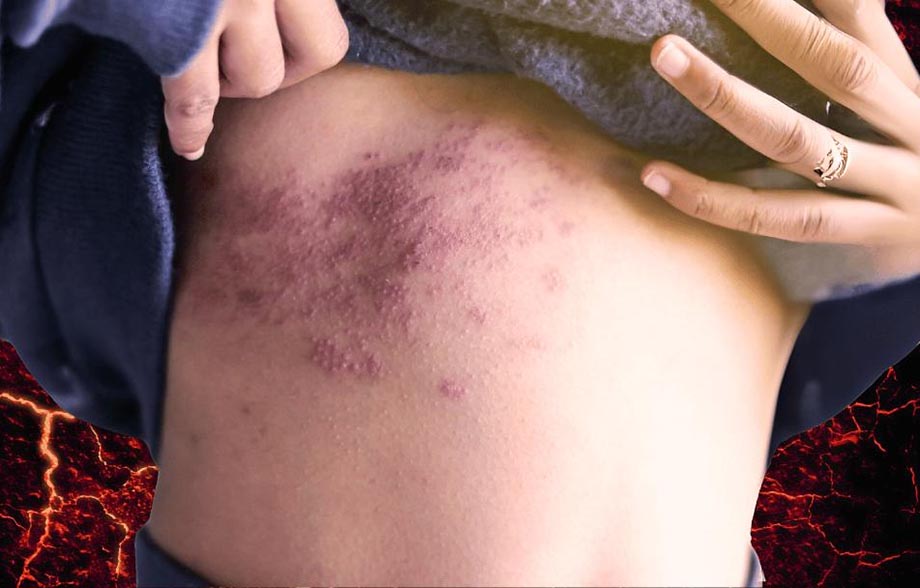
Población con diabetes en riesgo de padecer herpes zóster y sus complicaciones