EFE, UNO TV, Europa Press. La OMS pidió a los países miembros que sean “extremadamente cautos” y “no se vean tentados” a comenzar a administrar terceras dosis de refuerzo de vacunas anticovid, algo que en su opinión no ayudará a equilibrar el reparto global de dosis.
Los datos científicos “no justifican por el momento” esa dosis de refuerzo, que además “incrementa la desigualdad” en un momento en el que muchos países en desarrollo todavía no han podido inmunizar a sus poblaciones más vulnerables, advirtió Didier Houssin, presidente del Comité de Emergencia de la OMS para Covid-19.
… El Instituto Nacional de Salud Pública informó que en México se encuentran las cuatro variantes de Covid-19 denominadas de “preocupación”.
En el marco del seminario: “Variantes del COVID-19 ¿Cuántas hay, dónde surgieron y qué sabemos de ellas?”, organizado por el instituto, los especialistas precisaron que las cuatro variantes notables que hay en el mundo son: Alfa, en Reino Unido; Beta, en Sudáfrica; Gamma, en viajeros de Brasil, y Delta, en Haití.
José Ernesto Ramírez, de la Unidad de Desarrollo Tecnológico e Investigación Molecular InDRE, enlistó las variantes de preocupación del coronavirus, presentes en algunas entidades del país: “La variante Alfa ha sido detectada en Chihuahua; la Beta, en Campeche; la Gamma, en el sur sureste en Quintana Roo y Yucatán; la Delta en Baja California y Sinaloa, Ciudad de México y Estados de México”.
… Los casos semanales de Covid-19 han aumentado 64.3% en Europa durante la última semana, según datos publicados por el Centro Europeo para el Control y la Prevención de Enfermedades (ECDC, por sus siglas en inglés).
El organismo europeo advirtió de que se observa una tendencia al aumento en 20 países. En los países más afectados, los aumentos más pronunciados y las tasas de notificación más elevadas se registraron entre las personas de 15 a 24 años, con aumentos limitados en las personas mayores de 65 años.
… … Cambio en porcentaje en tendencia semanal en Colombia: -26%. Estaremos reportando los cambios de los países en donde circulamos. Para conocer la situación en otros países consulta: https://www.worldometers.info/coronavirus/weekly-trends/#countries
Hoy también publicamos las siguientes notas y más...
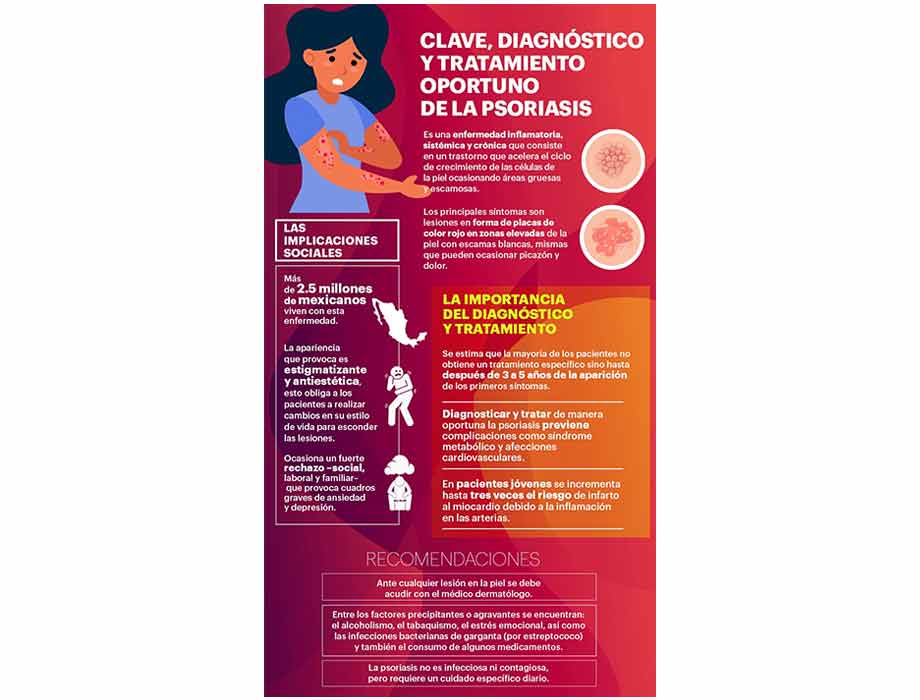
Al menos 2.5 millones de mexicanos padecen psoriasis; fundamental detectar y tratar oportunamente
Fedefarma analiza retos y aprendizajes del Covid-19 en Centroamérica y El Caribe