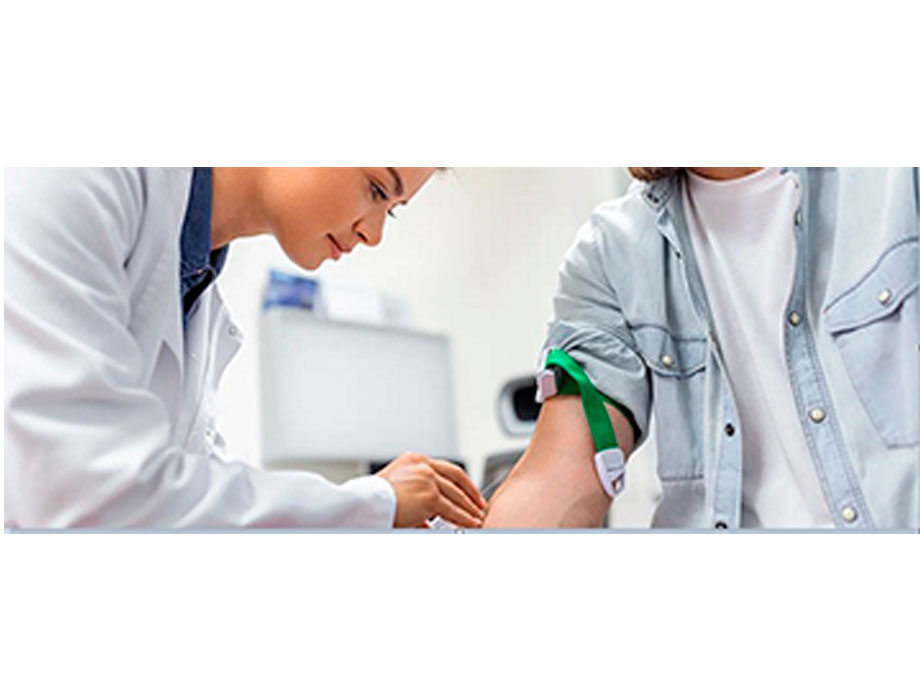
Comunicado. Durante el año pasado, Amgen ayudó a miles de personas a tomar medidas importantes para conocer más sobre su salud cardíaca a través de su programa gratuito de análisis de colesterol LDL. Como parte de este esfuerzo, la compañía está facilitando aún más el acceso a los análisis de colesterol en las comunidades de todo Estados Unidos.
Ahora, las personas pueden obtener un análisis de colesterol LDL sin costo en aproximadamente 1,000 sucursales de MinuteClinic, que se encuentran dentro de farmacias CVS seleccionadas en todo el país.
Amgen también seguirá ofreciendo pruebas de colesterol LDL gratuitas en el hogar y en el laboratorio para las personas que se inscriban.
“Gracias a los esfuerzos colectivos de organizaciones y expertos en enfermedades cardiovasculares, hemos ayudado a miles de personas a obtener pruebas de colesterol LDL sin costo, atención cardiovascular avanzada para millones de pacientes y hemos acelerado programas que abordan las desigualdades en la salud cardíaca. Esta iniciativa es otro ejemplo de cómo estamos avanzando en nuestra audaz ambición de reducir a la mitad la cantidad de ataques cardíacos y accidentes cerebrovasculares para 2030”, indicó Murdo Gordon, vicepresidente ejecutivo de Operaciones Comerciales Globales de Amgen.
Y por su parte, Creagh Milford, presidente de Retail Health, CVS Health, indicó: “Los ataques cardíacos y los accidentes cerebrovasculares se pueden reducir mediante la detección temprana y el control de los niveles de colesterol LDL. Los análisis de colesterol son una herramienta importante para ayudar a los pacientes a comprender su salud cardiovascular”.
Hoy también publicamos las siguientes notas y más...
Brasil lanza producción local de medicamentos para la obesidad y la diabetes
¡No te pierdas nuestra edición de enFarma 25.3!