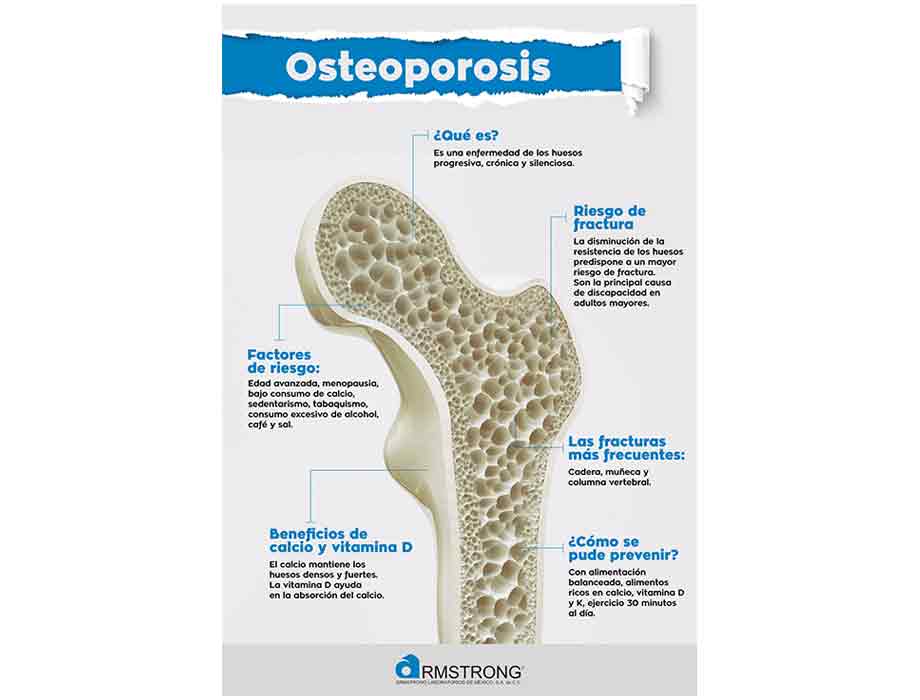
Comunicado. La Cofepris emitió una alerta sanitaria sobre la comercialización ilegal del producto Actemra (tocilizumab), de Roche, en cualquier presentación, ya que no cuenta con registro sanitario en México, y su consumo representa un riesgo para la salud.
La alerta es publicada después de un proceso de análisis técnico de la evidencia recabada, la cual indica que el producto se ha comercializado de manera ilegal en el país, particularmente en presentaciones de inyección de 400 miligramos (mg) /20 mililitros (mL) y 200mg/10mL.
De acuerdo con evidencia presentada por Productos Roche, S.A. de C.V., el producto tampoco corresponde con el original, denominado Roactemra®, con registro sanitario 044M2009 SSA IV, reforzando la recomendación de no administrarlo.
En este sentido, Cofepris recomienda a las personas que identifiquen el producto Actemra® (tocilizumab) suspender su uso y contactar a un profesional de la salud para continuar su tratamiento médico, realizar una denuncia sanitaria precisando la ubicación del punto de venta del producto, para lo cual pone a disposición su página https://www.gob.mx/cofepris/acciones-y-programas/denuncias-sanitarias y reportar cualquier reacción adversa o malestar relacionado con el consumo del producto en la página la comisión.
Adquirir medicamentos solo en establecimientos formalmente constituidos que cuentan con licencia sanitaria o aviso de funcionamiento.
En el caso de distribuidores o farmacias, la Cofepris informó que no deberán adquirir el producto en cualquier presentación o número de lote, y si cuentan con él en almacén, se solicita inmovilizarlos y realizar una denuncia sanitaria ante Cofepris.
Hoy también publicamos las siguientes notas y más..
Inmunoterapia cumple 10 años en México