Comunicado. Recientemente, la Cofepris autorizó Phesgo, de Roche, una alternativa que representa un parteaguas en el tratamiento de este subtipo de cáncer en etapas: tempranas -en neoadyuvancia (antes de la cirugía) y adyuvancia (después de cirugía para minimizar el riesgo de recurrencia)-, y metastásicas.
En México, cada año se diagnostican 29,929 nuevos casos de cáncer de mama, de los cuales 7,931 se reflejan en muertes. Ante este panorama, desde hace más de 30 años, Roche se ha comprometido a investigar y desarrollar nuevas y mejores terapias para cambiar el tratamiento de esta enfermedad, trayendo a las pacientes, especialistas y sistemas de salud, alternativas para enfrentar el desafío médico que el cáncer de mama representa para las mujeres mexicanas y para el sistema de salud.
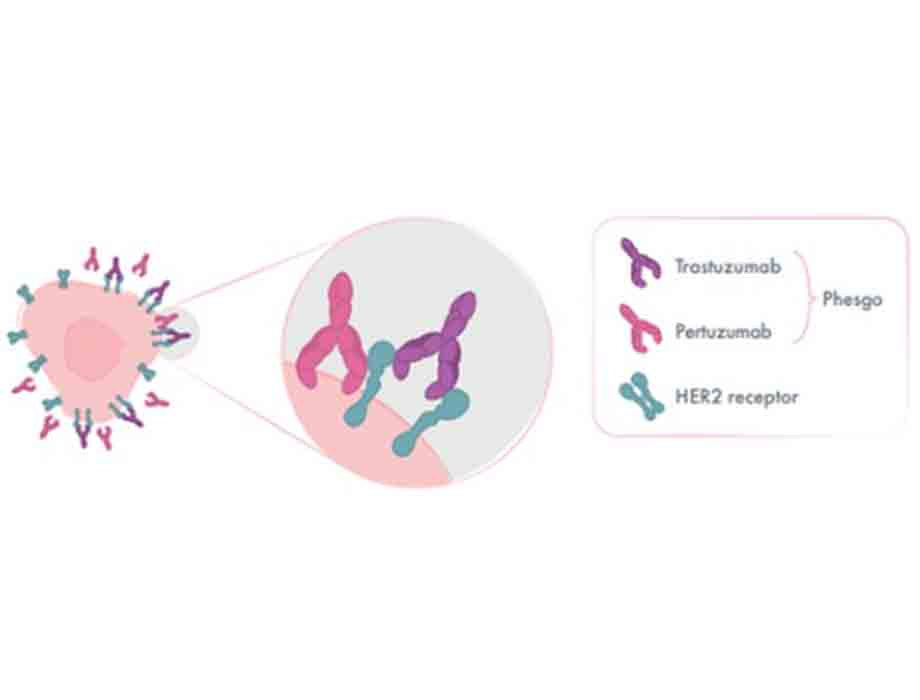
Así fue como en el año 2000, la firma se acercó a las pacientes mexicanas el primer medicamento personalizado (trastuzumab) para el cáncer de mama dirigido a la sobreexpresión de un gen en particular: HER2. Años más tarde, en 2012, introdujo pertuzumab apostando para que dos tratamientos pudieran trabajar juntos, de manera complementaria, para tratar este tipo de cáncer de mama de manera efectiva.
Phesgo es la combinación de trastuzumab y pertuzumab en un solo vial que se administra de manera subcutánea en ocho minutos, frente a las terapias intravenosas que requiere un proceso de más de tres horas.
Maryet Pérez, directora médica de Roche México, señaló: “Esta opción terapéutica significa flexibilidad para las pacientes, quienes reducen su tiempo de estancia en el hospital y los centros de infusión; pero también significa flexibilidad y sustentabilidad para los sistemas de salud que pueden liberar tiempo y recursos de las instalaciones hospitalarias para atender a otros pacientes”
“La evolución de este tratamiento a su aplicación subcutánea en una dosis fija, brinda la misma seguridad y respuesta patológica completa* que la versión intravenosa; además genera mayor comodidad a las pacientes, menos impacto emocional al no tener que pasar horas en el hospital y menos dolor, lo que permite una mayor adherencia al tratamiento. En el caso de los profesionales de la salud, hablamos de que, en lugar de realizar un proceso de veinte pasos para la aplicación intravenosa, con la subcutánea solo se realizan ocho pasos, liberando tiempo indispensable para dar atención a otros pacientes”, señaló Roxanna Flores, gerente de estrategia de acceso para Roche México.
Hoy también publicamos las siguientes notas y más...
PiSA Farmacéutica confirma su compromiso con la sustentabilidad
Moderna anuncia datos positivos de fase 1/2 de su vacuna combinada